
分析 (1)a保持容积不变,b保持内外压强相等,反应3A(g)+B(g)?2C(g)+D(g)是气体物质的量减少的反应,平衡时a中压强比b中小,故b相当于在a平衡的基础上加压,平衡右移,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡;
(2)改变起始投料比,要想达到平衡后a中C的浓度仍为N mol•L-1,恒温恒容下,与原平衡是完全等效平衡,按化学计量数转化到方程式左边,满足与原平衡中相同物质的起始投料量相等;
b中C的浓度为n mol•L-1,与原平衡为等效平衡,等温等压的条件下,按化学计量数转化到方程式左边,满足与原平衡中物质的投料量比;
(3)若将2molC和2molD充入a中,等效为开始投入3molA(g)、1molB(g)、1molD(g),与原平衡相比平衡逆向移动;
(4)将4 mol C和2 mol D充入a中相当于开始充入6 mol A、2 mol B,压强增大,平衡向右移动,反应物转化率增大,参加反应的A的物质的量大于原平衡的2倍,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡.
解答 解:(1)a保持容积不变,b保持内外压强相等,反应3A(g)+B(g)?2C(g)+D(g)是气体物质的量减少的反应,平衡时a中压强比b中小,故b相当于在a平衡的基础上加压,平衡右移,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡,故b中平衡时A的浓度大于a中A的平衡浓度,即M<m,平衡右移,b中C的平衡浓度高于a中C的平衡浓度,即N<n,
故答案为:<,<;
(2)改变起始投料比,要想达到平衡后a中C的浓度仍为N mol•L-1,恒温恒容下,与原平衡是完全等效平衡,按化学计量数转化到方程式左边,满足与原平衡中相同物质的起始投料量相等,选项中DE符合;
b中C的浓度为n mol•L-1,与原平衡为成比例等效平衡,等温等压的条件下,按化学计量数转化到方程式左边,满足与原平衡中物质的投料量比相等,选项中ADE符合,
故答案为:DE;ADE;
(3)若将2molC和2molD充入a中,等效为开始投入3molA(g)、1molB(g)、1molD(g),与原平衡相比平衡逆向移动,故平衡时A的浓度增大,C的浓度减小,即W>M、Y<N,
故答案为:>;<;
(4)将4mol C和2 mol D充入a中相当于开始充入6 mol A+2 mol B,压强增大,平衡向右移动,反应物转化率增大,参加反应的A的物质的量大于原平衡的2倍,平衡时A的浓度小于原平衡的2倍,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡,故M<R<2M,
故选:C.
点评 本题考查化学平衡移动与计算,难度中等,注意利用等效思想设计平衡建立的途径,理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.


科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液中加入铝片:Al+4OH-═AlO2-+2H2O | |
| B. | 澄清石灰水与足量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| D. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、SO42-、H+ | B. | K+、AlO22-、H+、Cl- | ||
| C. | Fe2+、H+、Cl-、NO3- | D. | Al3+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液和盐酸 | B. | BaCl2溶液、盐酸、澄清石灰水 | ||
| C. | BaCl2溶液、AgNO3溶液 | D. | BaCl2溶液、盐酸、品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
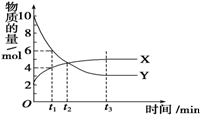 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )| A. | 反应的化学方程式为7Y?3X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,反应达到平衡状态,正、逆反应速率相等 | |
| D. | t3时,反应达到平衡状态,逆反应速率等于正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的水溶液能导电,所以氯气是电解质 | |
| B. | 干燥的氯气无漂白性,液氯具有极强的漂白性 | |
| C. | 氯气能使紫色石蕊溶液先变红后褪色 | |
| D. | 铜在氯气中燃烧生成红棕色烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要不加入其他物质,液氨中c(NH4+ )总是等于c(NH2- ) | |
| B. | 一定温度下,c(NH4+ )×c(NH2- )为常数 | |
| C. | 其他条件不变,增加液氨的量,电离平衡正向移动 | |
| D. | 维持温度不变,向液氨中加入少量氯化铵固体,c(NH2-)将减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com