
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸溶液的浓度和体积 ; ②碱溶液的浓度和体积 ;③比热容;④反应后溶液的质量;⑤ 生成水的物质的量;⑥反应前后温度的变化; ⑦操作所需的时间。
A.①②③⑥ B.③④⑤⑥ C.①③④⑤ D.全部
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:选择题
下列说法正确的是
A.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B.加热0.1mol/LNa2CO3溶液, CO32-的水解程度和溶液的pH均增大
CO32-的水解程度和溶液的pH均增大
C.1 L 1 mol•L―1的Na ClO溶液中含有ClO―的数目为6.02×1023
ClO溶液中含有ClO―的数目为6.02×1023
D.相同条件下,溶液中Fe2+、Cu2+、Zn2+的氧化性依次减弱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
下列各装置中都盛有0.1mol/L的NaCl溶液,放置一定时间后,装置中的四块相同的锌片,腐蚀速率由快到慢的正确顺序是
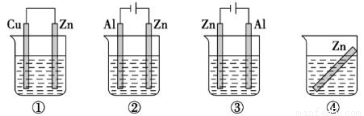
A.③①④②
B.①②④③
C.①②③④
D.②①④③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中 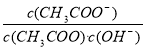 不变
不变
C.醋酸的电离程度增大,c(H+)也增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
某密闭容器中发生反应:X(g)+3Y(g) 2Z(g) △H<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) △H<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
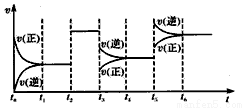
A.t2时加入了催化剂 B.T3时平衡的移动可使化学平衡常数减小
C.t5时增大了压强 D.T6时达到平衡后反应物的转化率最大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
实验编号 | HA物质的量浓度/ | NaOH物质的量浓度/ | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?____________.
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系____________.
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是____________.
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=_________mol•L-1.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:选择题
用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是
A.20 mL 2 mol/L FeCl3溶液 B.40 mL 1 mol/L NaHCO3溶液
C.20 mL 1 mol/L Na2SO3溶液 D.40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:选择题
甲醇质子交换器膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g) ΔH= +49.0 kJ
②CH3OH(g)+1/2O2(g)→CO2(g)+2H2(g) ΔH=-192.9 kJ
根据上述反应,下列说法正确的是
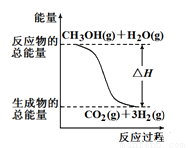
A.反应①中的能量变化如上图所示
B.可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8KJ/mol
C.1molCH3OH充分燃烧放出的热量为192.9KJ
D.CH3OH转变成H2的过程一定要吸收热量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
T℃时。体积均为0.5L的两个恒容密闭容器中发生可逆反应:
2A(g)+B(g) 2C(g)△H=-QkJ/mol(Q>0)
2C(g)△H=-QkJ/mol(Q>0)
实验测得反应在起始、达到平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75Q kJ |
② | 0.4 | 0.2 | 1.6 | |
下列叙述正确的是
A.容器①、②中反应的平衡常数均为36
B.容器②中反应达到平衡时放出的热量为0.05 Q kJ
C.向容器①中通入氦气,平衡时A的转化率不变
D.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com