
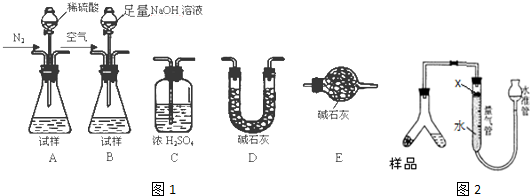
分析 I.(1)制备反应原理可知,Al2O3+3C+N2 $\stackrel{高温}{→}$2AlN+3CO,若反应不完全,会含有固体杂质碳、氧化铝;
(2)由题目信息可知,由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,据此生成方程式;
(3)根据实验原理,测定氨气的质量,可以先用碱溶液与样品反应,将生成的氨气先用碱石灰干燥,再用浓硫酸吸收,为防止空气的水份被浓硫酸吸收,在浓硫酸装置后面再连一个装有碱石灰 的干燥管;
II.(4)图2是用排液体的量气方法,由于氨气极易溶于水,所以在水的上面应放少量有机物,该有机物的密度应小于水;
(5)若量气管中的液体上方留有少量空间对测得NH3的体积将没有影响,读数时应保持量气管和水准管两边的液面高度一样,如果量气管中的液面低于水准管的液面,则产生的氨气的受到的压强大于空气中的压强,使测得NH3的体积会偏小;
(6)计算出氨气的体积为amL(标况下)的物质的量,再根据方程式计算出AlN的物质的量,进而计算AlN的质量,利用质量分数的定义计算样品中AIN的质量分数.
解答 解:I.(1)制备反应原理可知,Al2O3+3C+N2 $\stackrel{高温}{→}$2AlN+3CO,若反应不完全,会含有固体杂质碳、氧化铝,故答案为:碳;氧化铝;
(2)由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,其反应方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)根据实验原理,测定氨气的质量,可以先用碱溶液与样品反应,将生成的氨气先用碱石灰干燥,再用浓硫酸吸收,为防止空气的水份被浓硫酸吸收,在浓硫酸装置后面再连一个装有碱石灰 的干燥管,所以按气流方向连接各装置,其顺序为:B→D→C→E,
故答案为:B;D;C;
II.(4)图2是用排液体的量气方法,由于氨气极易溶于水,所以在水的上面应放少量有机物,该有机物的密度应小于水且难溶于水,故选ac;
(5)若量气管中的液体上方留有少量空间对测得NH3的体积将没有影响,读数时应保持量气管和水准管两边的液面高度一样,如果量气管中的液面低于水准管的液面,则产生的氨气的受到的压强大于空气中的压强,使测得NH3的体积会偏小,
故答案为:不变;偏小;
(6)氨气的体积为amL(标况下)的物质的量为 $\frac{a×10{\;}^{-3}L}{22.4L/mol}$=$\frac{a×1{0}^{-3}}{22.4}$mol,由方程式AlN+NaOH+H2O=NaAlO2+NH3↑可知,样品中AlN的物质的量为$\frac{a}{22.4}$×10-3 mol,所以AlN的质量为 $\frac{a}{22.4}$×10-3mol×41g/mol=$\frac{41a×1{0}^{-3}}{22.4}$g,样品中AIN的质量分数为$\frac{\frac{41a×1{0}^{-3}}{22.4}}{w}$×100%=$\frac{41a}{224w}$%,
故答案为:$\frac{41a}{224w}$%.
点评 该题为典型的样品纯度测验试题,并要求对已有的实验方案的评价,并指出方案不可行的原因以及在已有实验的基础上进行新的实验设计,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识,难度很大.


科目:高中化学 来源: 题型:选择题

| A. | 锌是正极,铜是负极,电流的方向是从锌到铜 | |
| B. | 锌片质量减少,铜片质量增加 | |
| C. | 正极和负极上发生的都是氧化还原反应 | |
| D. | 原电池中的能量变化是:化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
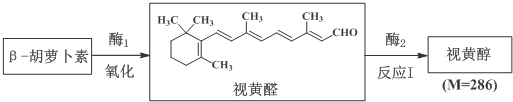
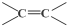 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$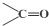 +
+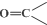
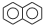 ,C10H8)的衍生物,其可能具有的化学性质有bd(选填编号).
,C10H8)的衍生物,其可能具有的化学性质有bd(选填编号).
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的官能团是:-OH | B. | 乙醇的分子式是:CH3CH2OH | ||
| C. | 乙烯的结构简式是:CH2CH2 | D. | 乙烯无官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧层破坏 | B. | 温室效应 | C. | 酸雨 | D. | 光化学烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高硫酸厂尾气的回收效率 | |
| B. | 强制燃煤企业完善脱硫设备 | |
| C. | 用天然气代替含硫的煤作民用燃料 | |
| D. | 减少全球工业化生产过程的CO2气体年排放总量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 药品 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com