
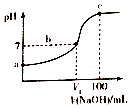
 已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )| A. | a点溶液的pH=4 | |
| B. | b点溶液中存在:c(A-)>c(Na+)>c(H+)=c(OH-) | |
| C. | b点c(HA)/c(A-)=5 | |
| D. | c点c(A-)+c(H+)=c(Na+)+c(OH-) |
分析 A.设出2mol/LHA溶液中氢离子浓度,c(A-)≈c(H+)=x,c(HA)≈2mol/L,然后结构电离平衡常数表达式列式计算,最后根据pH=-lgc(H+)计算;
B.b点溶液的pH=7,呈中性,则c(H+)=c(OH-),结合电荷守恒判断;
C.b点pH=7,c(H+)=1×10-7mol/L,然后结合电离平衡常数Ka=2.0×10-8计算;
D.c点溶液呈碱性,则c(H+)<c(OH-),结合电荷守恒判断.
解答 解:A.设2mol/LHA溶液中电离出氢离子浓度为x,则c(A-)≈c(H+)=x,c(HA)≈2mol/L,HA的电离常数Ka=$\frac{x×x}{2mol/L}$=2.0×10-8,解得x=2×10-4mol/L,则a点溶液的pH=-lg2×10-4=4-lg2≈3.7,故A错误;
B.b点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知:c(A-)=c(Na+),正确的离子浓度大小为:c(A-)=c(Na+)>c(H+)=c(OH-),故B错误;
C.根据图象可知,b点溶液呈中性,则1×10-7mol/L,根据Ka=$\frac{c({A}^{-})•c({H}^{+})}{c(HA)}$可知:$\frac{c(HA)}{c({A}^{-})}$=$\frac{c({H}^{+})}{{K}_{a}}$=$\frac{1×1{0}^{-7}}{2×1{0}^{-8}}$=5,故C正确;
D.c点溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(Na+)>c(A-),则c(A-)+c(H+)<c(Na+)+c(OH-),故D错误;
故选C.
点评 本题考查溶液酸碱性与溶液pH的计算,题目难度中等,明确电离平衡常数表达式、电荷守恒的含义为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
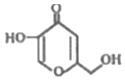
| A. | 分子中所有碳原子不可能共平面 | |
| B. | 能发生酯化反应、氧化反应、还原反应 | |
| C. | lmol该物质与H2完全加成,需消耗3mol H2 | |
| D. | 比该物质少一个O原子,属于芳香族化合物的同分异构体有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| B. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 34g H2O2和H2S混合物中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 生成的盐 | 化学式 | 质量/g |
| A | ||
| B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.48 L | B. | 5.6 L | C. | 6.7 L | D. | 7.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式 | B. | 按规定对生活废弃物进行分类放置 | ||
| C. | 经常使用一次性筷子、塑料袋 | D. | 深入农村和社区,加强环保宣传 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未加NaOH溶液时,c(H+)>c(CI-)═c(CH3COOH) | |
| B. | 加入10mLNaOH溶液时:c(CH3COO-)+c(OH-)═c(H+) | |
| C. | 加入NaOH溶液至PH=7时:c(Na+)═c(CI-) | |
| D. | 加入20mLNaOH溶液时:c(Na+)═c(CH3COO-)+c(CI-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | Na2O2中既含有离子键又含有非极性共价键 | |
| C. | KOH中只含有共价键 | |
| D. | KI和HI中化学键类型完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com