
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
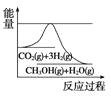
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
【答案】温度 bc 0.16mol/(L·min) 吸 b=2a,a>1(或使用合适的催化剂) cd
【解析】
(1)①利用判据:△H-T△S<0,得:与温度有关
②a、容积可变的密闭容器,则无论是否达平衡,压强不变,故a错误;
b、1mol H-H键断裂,表示v逆(H2),断裂2mol H-O键,表示v正(H2O),且两者相等,可以说明反应达到平衡,故b正确;
c、v正(CO)=v逆(H2O),可以说明反应达到平衡,c正确;
d、由于该反应涉及工业生产,根据方程式的化学计量系数可知:无论是否达平衡,c(CO)=c(H2),故d错误;
故选bc;
(2)① CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
系数 1 1 1 1
C0 2 1 0 0
△C 0.8 0.8 0.8 0.8
C(平衡)1.2 0.2 0.8 0.8
实验1中以v(CO2)= ![]() =
=![]() =0.16mol/(L·min);
=0.16mol/(L·min);
并计算,得:K(650℃) =![]() =2.67;
=2.67;
② CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
系数 1 1 1 1
C0 1 0.5 0 0
△C 0.2 0.2 0.2 0.2
C(平衡)0.8 0.3 0.2 0.2
同理:计算,得K(900℃) =![]() =0.17,说明升温,K值减小,平衡左移,则逆向为吸热的;
=0.17,说明升温,K值减小,平衡左移,则逆向为吸热的;
③等温、等容下的等效平衡(且压强不影响该平衡移动),即:a:b=1:2,t<3 min,即增大反应速率,所以a>1(或使用合适的催化剂);
(3)能使 c(CH3OH)增大,即平衡右移:
a、由图像知:正向为放热的,而升温,平衡左移,故a错误;
b、充入He(g),压强增大,该反应是气体体积不变的反应,平衡不移动,故b错误;
c、将H2O(g)从体系中分离出来,平衡右移,故c正确;
d、再充入1mol CO2和3mol H2,增大反应物浓度,平衡右移,故d正确;
故选cd。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
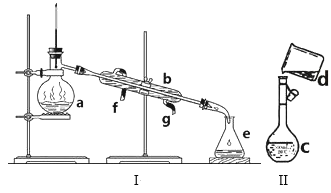
(1)写出下列仪器的名称:a.__ b.__ c.__。
(2)仪器a~e中,使用前必须检查是否漏水的有__。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__,将仪器补充完整后进行实验,温度计水银球的位置在__处。冷凝水由__(填f或g)口通入,__口流出。
(4)现需配制0.1mol/LNaOH溶液500mL,装置II是某同学转移溶液的示意图。
①图中的错误是__。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:___。
②根据计算得知,所需NaOH的质量为__g。
③配制时,正确操作顺序是(字母表示,每个字母只用一次)__。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
④用“偏大”“偏小”或“无影响”填空
A.配制NaOH溶液,需称量一定质量的溶质,称量时使用了游码,但物码放置颠倒__。
B.配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容__。
C.定容摇匀后,发现液面下降,继续加水至刻度线__。
D.定容时仰视刻度线__。
E.容量瓶中原有少量蒸馏水__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种长效、缓释阿司匹林的合成路线如下图所示:
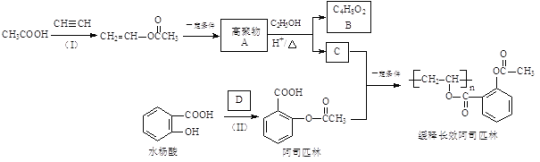
完成下列填空:
已知: RCOOR′+R"OH![]() RCOOR"+R′OH(R、R′、R"代表烃基)
RCOOR"+R′OH(R、R′、R"代表烃基)
(1)结构简式:A______________,B_______________;
(2)反应(Ⅰ)的反应类型为_________________,缓释长效阿司匹林结构中与“缓释作用”有关的官能团的名称为________________。
(3)D为乙酸酐,结构简式为![]() ,写出一种与D互为同分异构体且能发生银镜反应的酯类的结构简式:__________。
,写出一种与D互为同分异构体且能发生银镜反应的酯类的结构简式:__________。
(4)已知水杨酸酸性主要来源于“![]() ”,阿司匹林中将“
”,阿司匹林中将“![]() ”转化为“
”转化为“![]() ”能大大降低对肠胃的刺激,由此你可以得出的结论是_________。
”能大大降低对肠胃的刺激,由此你可以得出的结论是_________。
(5)已知:①乙炔与无机酸的反应和反应(Ⅰ)类似;②![]() ,现以乙炔、甲醇为原料,无机试剂任选,合成丙烯酸甲酯(
,现以乙炔、甲醇为原料,无机试剂任选,合成丙烯酸甲酯(![]() )_________。(合成路线常用的表示方式为:
)_________。(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究。查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
I.摩擦剂中氢氧化铝的定性检验,取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量![]() 溶液,过滤。氢氧化铝与
溶液,过滤。氢氧化铝与![]() 溶液反应的离子方程式是___________
溶液反应的离子方程式是___________
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察的现象是__________
Ⅱ.牙膏样品中碳酸钙的定量测定。利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的![]() 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。
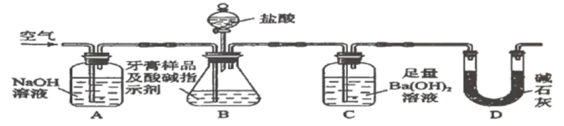
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_____。
(4)C中反应生成沉淀的离子方程式是_______________。
(5)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的![]() 气体
气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取![]() 样品三份,进行三次测定,测得
样品三份,进行三次测定,测得![]() 平均质量为
平均质量为![]() 。则样品中碳酸钙的质量分数为_____________________。
。则样品中碳酸钙的质量分数为_____________________。
(7)有人认为不必测定C中生成的![]() 质量,只要测定装置C在吸收
质量,只要测定装置C在吸收![]() 前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________________。
前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是![]() 和
和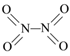 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g)![]() 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
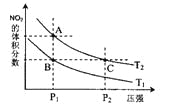
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol·(L·s)-1。
②n3____n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________,升高温度后,反应2NO2![]() N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某研究小组拟设计微生物燃料电池将污水中的乙二胺![]() 氧化成环境友好的物质,再利用该装置模拟工业电解法来处理含
氧化成环境友好的物质,再利用该装置模拟工业电解法来处理含![]() 废水,电解过程溶液中发生反应为
废水,电解过程溶液中发生反应为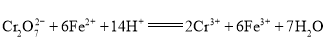 。当电池工作时,下列说法错误的是( )
。当电池工作时,下列说法错误的是( )
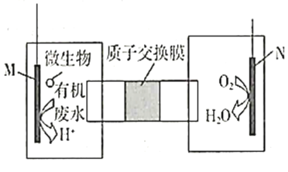
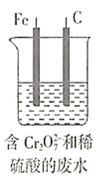
A.Fe棒应与N极相连
B.![]() 透过质子交换膜由右向左移动
透过质子交换膜由右向左移动
C.若溶液中减少了![]()
![]() ,则电路中至少转移
,则电路中至少转移![]() 电子
电子
D.M极电极反应式为H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制出丁苯酞,标志着我国在脑血管疾病治疗药物研究领域达到了国际先进水平。合成丁苯酞(J)的一种路线如下:
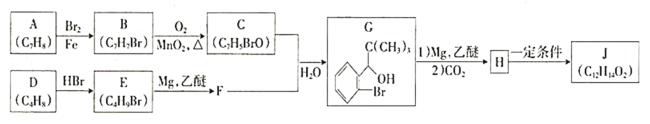
已知:
①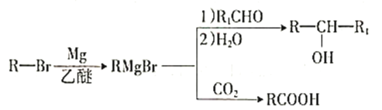
②E的核磁共振氢谱只有一组峰;
③J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)A的化学名称为________,H中官能团的名称为________、________。
(2)由A生成B反应类型为__________________。
(3)由D生成E的化学方程式为__________________。
(4)J的结构简式为________________。
(5)![]() 与CO2反应生成X,X的同分异构体中:
与CO2反应生成X,X的同分异构体中:
①能发生水解反应;②能发生银镜反应;能与氯化铁溶液发生显色反应。
满足上述条件X的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱有五组峰的同分异构体结构简式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
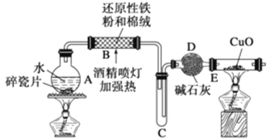
探究一:设计如图所示装置进行“铁与水反应”的实验
(1)硬质玻璃管E中反应的化学方程式为_________
(2)反应前A中投放碎瓷片的目的是_________
(3)装置E中的现象是_________
探究二:设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
实验操作:待硬质玻璃管B冷却后,取少许其中的固体物质溶于稀硫酸后,将所得溶液分成两份。
(4)一份滴加几滴KSCN溶液。若溶液变血红色,推断硬质玻璃管B中固体物质的成分为________(选填序号,下同);写出溶液变血红色的离子方程式:____________,若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为_________。
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
(5)另一份用_________(填仪器名称),加入_________(填试剂),观察观察到_________(填实验现象),可以证明溶液中存在Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.( ![]() -
-![]() ) mol/LB.(2b-a) mol/L
) mol/LB.(2b-a) mol/L
C.(5b-![]() ) mol/LD.(10b-5a) mol/L
) mol/LD.(10b-5a) mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com