
 实验室可用如图所示装置(缺少收集装置,夹持固定装置以略去)制备并收集氨.
实验室可用如图所示装置(缺少收集装置,夹持固定装置以略去)制备并收集氨.分析 制备NH3用NH4Cl和Ca(OH)2,氨气密度小于空气,收集的NH3,用向下排空气法,一水合氨的电离是可逆的,生成铵离子和氢氧根显碱性,遇到酚酞变红色;
(1)烧瓶收集氨气,需要用双孔塞,导气管长进短出;
(2)实验室制备氨气是利用固体氢氧化钙和氯化铵固体加热制备;
(3)氨气极易溶于水,氨气和水反应生成一水合氨是弱碱,溶液中存在电离平衡,一水合氨电离出氢氧根离子,溶液显碱性.
解答 解:制备NH3用NH4Cl和Ca(OH)2,氨气密度小于空气,收集的NH3,用向下排空气法,一水合氨的电离是可逆的,生成铵离子和氢氧根显碱性,遇到酚酞变红色;
(1)需要双孔塞,用烧瓶收集氨气的仪器装置简图为 ,故答案为:
,故答案为: ;
;
(2)试管中是制备氨气的反应,所选的试剂是NH4Cl和Ca(OH)2,故答案为:NH4Cl和Ca(OH)2;
(3)氨气极易溶于水,烧杯中形成一水合氨溶液,一水合氨存在电离生成铵根离子和氢氧根离子,即NH3•H2O?NH4++OH-,显碱性,遇到酚酞由无色变为红色,
故答案为:NH3•H2O?NH4++OH-.
点评 本题考查了实验室氨气的制备、收集装置分析,主要是制备原理和收集装置的理解应用,题目较简单.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:解答题

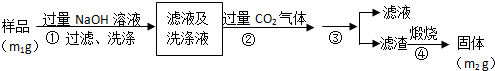
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 降低温度 | C. | 通入氦气 | D. | 加入催化剂 | ||||
| E. | 移出氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离程度 | B. | 酸的物质的量浓度 | ||
| C. | 与Zn反应开始时的反应速率 | D. | 与足量的Zn反应产生H2量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51% | B. | 56% | C. | 57% | D. | 10% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
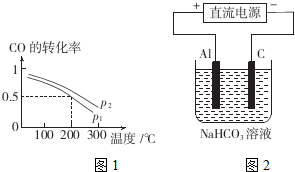
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
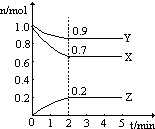 某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,
某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,查看答案和解析>>
科目:高中化学 来源: 题型:解答题

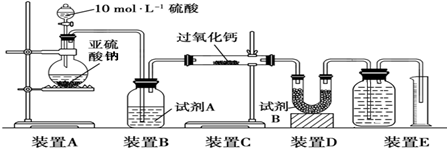
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com