
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应至6min时,c(H2O2)=0.3mol/L | |
| D. | 反应至6min时,H2O2分解了50% |
分析 A.0~6min,生成O2为$\frac{22.4×1{0}^{-3}L}{22.4L/mol}$=0.001mol,由2H2O2?2H2O+O2↑可知,分解的过氧化氢为0.002mol,结合v=$\frac{△c}{△t}$计算;
B.6~10min,生成O2为$\frac{(29.9-22.4)×1{0}^{-3}L}{22.4L/mol}$=0.33×10-3mol,由2H2O2?2H2O+O2↑可知,分解的过氧化氢为0.66×10-3mol,结合v=$\frac{△c}{△t}$计算;
C.反应至6min时,剩余H2O2为0.01L×0.4mol/L-0.002mol=0.002mol,结合c=$\frac{n}{V}$计算;
D.反应至6min时,分解的过氧化氢为0.002mol,开始的H2O2为0.01L×0.4mol/L=0.004mol,结合转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:A.0~6min,生成O2为$\frac{22.4×1{0}^{-3}L}{22.4L/mol}$=0.001mol,由2H2O2?2H2O+O2↑可知,分解的过氧化氢为0.002mol,v(H2O2)=$\frac{△c}{△t}$=$\frac{\frac{0.002mol}{0.01L}}{6min}$=0.033mol/(L•min),故A正确;
B.6~10min,生成O2为$\frac{(29.9-22.4)×1{0}^{-3}L}{22.4L/mol}$=0.33×10-3mol,由2H2O2?2H2O+O2↑可知,分解的过氧化氢为0.66×10-3mol,v=$\frac{△c}{△t}$=$\frac{\frac{0.66×1{0}^{-3}mol}{0.01L}}{4min}$=0.0165mol/(L•min),或随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢,6~10 min的平均反应速率小于0~6min时间内反应速率,故B正确;
C.反应至6min时,剩余H2O2为0.01L×0.4mol/L-0.002mol=0.002mol,c(H2O2)=$\frac{0.002mol}{0.01L}$=0.2mol/L,故C错误;
D.反应至6min时,分解的过氧化氢为0.002mol,开始的H2O2为0.01L×0.4mol/L=0.004mol,转化率=$\frac{转化的量}{开始的量}$×100%=$\frac{0.002}{0.004}$×100%=50%,故D正确;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据的应用、速率及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意利用氧气的变化量计算过氧化氢的量,题目难度不大.


科目:高中化学 来源: 题型:实验题
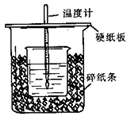 用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
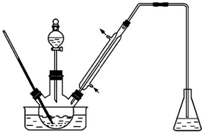 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置如图,相关物质的沸点见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置如图,相关物质的沸点见附表).| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
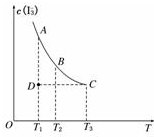 实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )| A. | 该反应的正反应是吸热反应 | B. | A点与C点的化学反应速率vA<vC | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | A点与B点相比,B点的c(I2)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
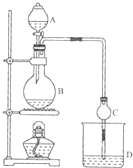 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- | |
| C. | $\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ba2+、Cl-、NO3- | |
| D. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com