
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
分析 (1)硅位于金属和非金属分界线附近,常用作半导体材料,为无机非金属材料的主角;
(2)A.根据硅酸盐中氧化物的书写顺序来书写;
B.硅酸盐性质稳定;
C.硅酸铜钡的化学式为BaCuSi2OX,利用钡、铜、硅、氧元素的化合价及化合物中正负化合价的代数和为0来解答;
D.硅酸盐能和强酸反应;
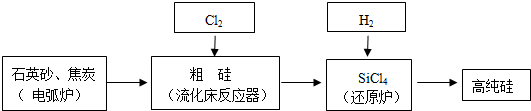
(3)①石英砂主要成分为二氧化硅,粗硅提纯是利用碳做还原剂还原二氧化硅为单质硅;根据反应不能自发进行△H-T△S>0判断;
②SiCl4水解生成硅酸和氯化氢;
③根据题中数据,采用精馏(或蒸馏)方法提纯SiCl4;
④根据KMnO4溶液具有强氧化性,把二价铁氧化成三价铁,本身被还原成二价锰离子结合得失电子守恒配平;先根据关系式5Fe2+~MnO4-计算出100mL溶液中含有的铁,最后求出质量百分数.
解答 解:(1)硅位于金属和非金属分界线附近,常用作半导体材料,为无机非金属材料的主角,计算机芯片的主要成分为单质硅,太阳能电池的主要成分是硅单质,所以硅可制半导体、制电路板、制太阳能电池板、制硅钢等,
故答案为:制半导体、制电路板、制太阳能电池板、制硅钢等;
(2)A.硅酸盐用氧化物形式表示时,书写顺序为:活泼金属氧化物、不活泼金属氧化物、二氧化硅、水,所以硅酸铜钡用氧化物形式表示:BaO•CuO•2SiO2,故A正确;
B.BaCuSi2O6中铜显+2价,二价铜离子不容易被还原,所以性质较稳定,不容易褪色,故B正确;
C.在硅酸铜钡中的铜元素化合价为+2,硅元素化合价为+4,氧元素的化合价为-2价,钡元素的化合价为+2价,则由化学式为BaCuSi2OX,根据化合物中正负化合价的代数和为0可得:(+2)+(+2)+(+4)×2+(-2)×x=0,解得x=6,故C正确;
D.BaCuSi2O6是弱酸盐,所以能和强酸反应,和强碱不反应,故D错误;
故答案为:D;
(3)①石英砂的主要成分是二氧化硅,制备粗硅发生置换反应,SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,该反应为△S为正值的反应△S>0,该反应不能自发进行,△H-T△S>0,所以△H>0,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si;>;
②SiCl4水解生成硅酸和氯化氢,反应的方程式为:SiCl4+3H2O=H2SiO3↓+4HCl,故答案为:SiCl4+3H2O=H2SiO3↓+4HCl;
③利用沸点的不同提纯SiCl4属于蒸馏,SiCl4(沸点57.6℃)中含有少量SiHCl3(沸点33.0℃)和FeCl3(离子化合物沸点很高),SiH2Cl2(沸点8.2℃)、SiH3Cl(沸点-30.4℃)、由于沸点差别较大,可以通过精馏(或蒸馏)除去杂质,
故答案为:精馏(或蒸馏);
④KMnO4溶液具有强氧化性,把二价铁氧化成三价铁,本身被还原成二价锰离子,再根据得失电子守恒配平,则离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,利用关系式法计算:
5Fe2+~MnO4-
5 1
n(Fe2+) 1.000×10-3mol•L-1×0.02L×5
解得:n(Fe2+)=5×10-4mol
铁元素的质量为:5×10-4mol×56g/mol=2.8×10-3g,铁元素的质量分数$\frac{2.8×1{0}^{-3}g}{1g}$×100%=2.8%,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;2.8%.
点评 本题考查了实验方案设计的有关知识,综合了氯气的制法、硅的提纯、滴定法等实验知识,侧重考查了硅及其化合物的有关知识,注意粗硅的提纯反应原理,明确硅酸盐用氧化物形式表示时书写顺序,氧化还原的计算,题目难度中等.


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ③⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
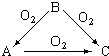 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.
常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
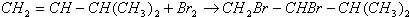 ;
;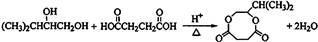 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com