
实验室中需要220mL0.5mol/L H2SO4,现用98%浓硫酸(密度为1.84g/cm3)稀释配制。
(1)本实验室中需要的容器是 。
(2)要将浓硫酸在 中稀释,稀释时的操作方法是 。
(3)必须将稀释后的硫酸 后再移液,原因是 ,
否则,所配制的稀硫酸浓度会 (偏高、偏低、无影响)。
科目:高中化学 来源: 题型:填空题
(1).等物质的量的CO和CO2中所含O原子个数之比 ,C原子数之比 ,二者的质量之比 。
(2)下列物质中:(1)Cu (2) Br2 ⑶Na2O ⑷蔗糖 ⑸NaCl溶液 ⑹ SO3 ⑺Ba(OH)2
属于电解质的是 , 属于非电解质的是 ,能导电的是 。(用序号填写)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示。则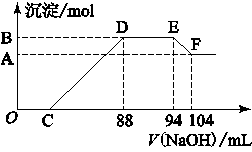
(1)B与A的差值为________mol;
(2)原硝酸溶液中含硝酸的物质的量为________mol;
(3)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为________;
(4)写出铝与该浓度硝酸反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
回答下列问题(填序号):
(1)下列仪器中:①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;
⑦燃烧匙。常用于物质分离的是________________,其中根据物质沸点不同来分离物质的仪器是____________。(用序号填写)
(2)今欲用NaOH固体配制220mL 0.2mol/L的NaOH溶液。根据题意填空:
| A.配制该溶液应选用玻璃仪器_________mL容量瓶。 |
| B.用托盘天平称取 ________g NaOH固体。 |
| C.将称好的NaOH固体放至烧杯中,倒入约25mL蒸馏水,用__________搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。 |
| D.用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并将每次洗涤的溶液都注入容量瓶, 轻轻摇动容量瓶,使溶液混和均匀。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用质量分数为98%,密度为1.84g·cm-3的浓硫酸配制l mol/L稀硫酸100mL,其操作有以下各步:
①用量筒量取 mL浓硫酸
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸转入100 mL容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
(1)第①步操作中应用量筒量取 mL浓硫酸;应选择 mL量筒(填5、10或50)。
(2)本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是 。
(3)正确的操作顺序是(用序号填写) 。
(4)下列操作会使实际浓度偏高,偏低还是不变,请填写:
1).摇匀后,液面低于刻度线,没有再加水;
2).移液过程中,不小心溅出少量溶液;
3).定容时,如果俯视刻度线,配制的硫酸浓度将
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)标准状况下,5.6LSO2的质量为 克,共含有 个原子。
(2)质量相同的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 (填分子式,下同),在相同温度和相同压强条件下,体积最大的是 。
(3)用托盘天平称取5.0 g CuSO4·5H2O晶体,溶于水配成100mL溶液,其物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列物质中,物质的量最大的是________,含原子个数最多的是________,质量最大的是________。
| A.3gH2; | B.标况下33.6LCO2; | C.1.204×1024个HCl分子; | D.49gH2SO4;E.46g乙醇(C2H5OH);F.4℃时10mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属钠在700℃ ~800℃时与四氯化钛(TiCl4)反应制取金属钛,该反应的化学方程式为 。若过量的相同质量的钠、镁、铝与相同质量分数,相同质量的硫酸溶液反应,产生氢气最多的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.770 0 g样品,配制成100.00 mL溶液A。②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 00 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42—)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥________mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4—被还原为MnO2,其离子方程式为______________。
(3)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com