
【题目】科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
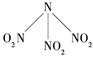
A. 分子中N、O间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2g该物质含有的原子数为6.02×1024
科目:高中化学 来源: 题型:
【题目】元素原子的核外电子排布决定了元素在元素周期表中的位置,已知某元素原子的核外电子排布式为1s22s22p63s23p63d34s2。该元素位于元素周期表
A. 第4周期第ⅤB族 B. 第4周期第ⅡA族
C. 第2周期第ⅡB族 D. 第5周期第ⅡB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探 究,并共同回答下列问题:
探究一:设计如图所示装置进行“铁与水反应”的实验(夹持仪器略).
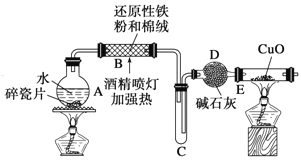
(1)硬质玻璃管 B 中发生反应的化学方程式为:________________________________.。
(2)反应前 A 中投放碎瓷片的目的是___________________.。
(3)装置 E 中的现象是_______________________。
探究二:设计如下实验方案确定反应后硬质玻璃管 B 中黑色固体的成分。
(4)待硬质玻璃管 B 冷却后,取少许其中的固体物质溶于___________________后,将所得溶液分成两份。
(5)一份滴加几滴 KSCN 溶液。若溶液变血红色,推断硬质玻璃管 B 中固体物质的成分为______________________(选 填序号,下同);若溶液未变血红色,推断硬质玻璃管 B 中固体物质的成分为__________________________________。
①一定有 Fe3O4 ②一定有 Fe ③只有 Fe3O4 ④只有 Fe
(6)另一份用_____(填仪器名称)加入_____(填试剂和现象),可以 证明溶液中存在 Fe2+。
探究三:设计如下流程测定反应后硬质玻璃管 B 中固体含铁元素的质量分数。
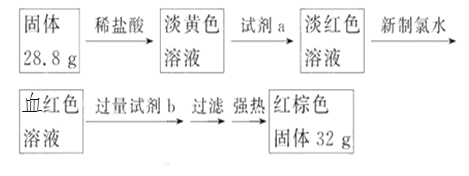
(7)试剂 b 的化学式是_____。
(8)计算反应后 B 装置中铁元素的质量分数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种仪器:①漏斗;②容量瓶;③温度计;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是( )
A.①③⑦B.②⑥⑦
C.①④⑧D.④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是 ( )
A.钢铁发生电化学腐蚀的正极反应式:Fe -2e- == Fe2+
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》记载:“烧酒,其法用浓酒和糟入甑,蒸令气上,用器承滴露”,“凡酸坏之酒,皆可蒸烧”。这里用到的实验方法可以用于分离()。
A. 甲苯与水 B. 乙醇与水 C. 碘与水 D. 硝酸钾与氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍;D是形成化合物种类最多的元素。
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为________;写出由甲制高聚物的反应方程式 。
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于________(“极性分子”或“非极性分子”);其电子式________;将乙加入浅绿色氯化亚铜溶液中,溶液变为棕黄色,写出该反应的离子方程式______________。
(3)写出B的基态原子电子排布图为 。与PH3相比,BA3易液化的主要原因是_____________;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与DC2分子具有相似的结构。故B2C的空间构型是________,其为________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子的2p能级有3个电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:
(1)写出基态E+的价电子排布式:_________。基态A原子的第一电离能比B的大,其原因是__________。
(2)A5+由美国空军研究实验室推进科学与先进概念部Karl .O. Christed 于1999年成功合成,其结构呈‘V'形且该离子中各原子均达到8电子稳定结构,则A5+的结构式为________。
(3)B3分子的空间构型为______,其中B原子的杂化类型是______,与B3分子互为等电子体的微粒有_________(写一种离子)。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。加入乙醇的目的___________。 写出该配合物中配离子的结构简式__________。
(5)由长周期元素组成的镧镍合金、铜钙合金有相同类型的晶体结构XYn,它们有很强的储氢能力,其中铜钙合金的晶体的部分结构如图所示。
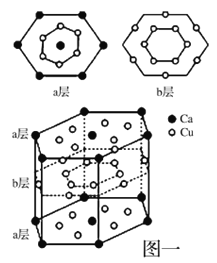
己知镧镍合金(LaNin)晶体中的重复结构单元如图一所示,该结构单元的体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶体空隙,体积不变),则LaNin中n=___ (填数值);氢在合金中的密度为_______g/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签的有关内容。试根据标签上的有关数据回答下列问题:
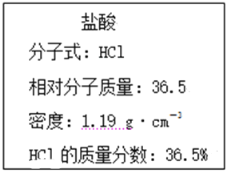
(1)该浓盐酸中HCl的物质的量浓度为_______________。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol·L-1的稀盐酸,需要量取上述___________mL浓盐酸进行配制。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com