
| A. | pH均为4的H2SO4、NH4Cl溶液中,水的电离程度相同 | |
| B. | 等pH的NaOH溶液与NH3•H2O 稀释后pH的变化如右图所示,则曲线I表示的是NaOH溶液的稀释 | |
| C. | 1mol/LNa2CO3溶液中存在:c(Na+)=2c(CO32- )+2c(HCO3-) | |
| D. | 向某温度的氨水中通入盐酸,则氨水的电离常数增大 |
分析 A、酸抑制水的电离,能够水解的盐促进水的电离;
B、一水合氨是弱碱,加水稀释促进电离;
C、据物料守恒分析;
D、电离常数只受温度影响.
解答 解:A、酸抑制水的电离,NH4Cl是强酸弱碱盐,促进水的电离,故A错误;
B、等倍数稀释后强碱的pH变化大,故B正确;
C、由物料守恒知在Na2CO3溶液中:c(Na+)=2[c(CO32- )+c(HCO3-)+c(H2CO3)],故C错误;
D、氨水中通入盐酸,平衡正向移动,弱电解质的电离常数只与温度有关,故电离平衡常数不变,故D错误;
故选B.
点评 本题主要考查电解质的概念,注意影响弱电解质电离平衡移动的因素、溶液中的物料守恒、电离平衡常数,题目较简单.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 将金属钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 大理石与醋酸的反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 三氯化铁溶液中加入铜粉:Cu+Fe3+═Cu2++Fe2+ | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温灼烧CuO固体 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 硫粉与铁粉混合加热 | D. | 将金属Cu投入FeCl3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
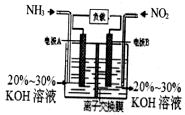 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为:2NH3-6e-=N2+6H+ | |
| D. | 当有4.48LNO2被处理时,转移电子数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中的空间构型为正四面体形 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.
;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
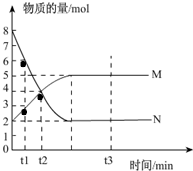 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
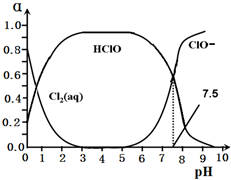 元素周期表中ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中ⅦA族元素的单质及其化合物的用途广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com