
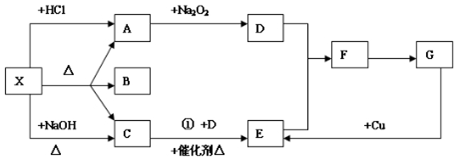
分析 根据题给条件很容易想到X可能是NH4HCO3或(NH4)2CO3.X和NaOH反应生成无色气体C,推知C为NH3,X是铵盐;X和盐酸反应生成无色气体A,A和Na2O2反应生成D,推知A为CO2,D为O2,进而推出E为NO,F为NO2,G为HNO3,浓度不同时,能和铜反应生成不同的气体,结合物质的性质进行解答.
解答 解:(1)由以上分析可知X可以是(NH4)2CO3 或NH4HCO3,C是 NH3,故答案为:(NH4)2CO3 或NH4HCO3; NH3;
(2)反应①为氨气的催化氧化,为工业制硝酸的反应,化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)F→G为二氧化氮和水的反应,化学方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(4)二氧化碳和过氧化钠反应,过氧化钠既是氧化剂也是还原剂,若生成1mol氧气,转移的电子数目为2NA,故答案为:Na2O2;2NA;
(5)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查无机物的推断以及元素化合物的性质,为高考常见题型,侧重考查学生的分析能力,题目难度中等,解答本题,在学习中要注意牢固掌握相关基础知识.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤所需实验用品有漏斗、烧杯、玻璃棒、铁架台(带铁圈) | |
| B. | 过滤时把漏斗放在铁三脚架上 | |
| C. | 过滤时将玻璃棒斜靠在三层滤纸上 | |
| D. | 过滤时为了加快过滤速度,用玻璃棒搅拌过滤器中的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
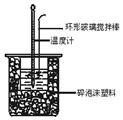 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )
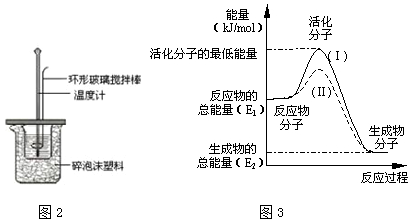
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )| A. | 改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| C. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失 | |
| D. | 实验中应记录测量出的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e |
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃[ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
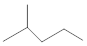 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.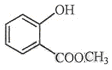 中含氧的官能团的名称为羟基,酯基.
中含氧的官能团的名称为羟基,酯基.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 起始温度T1/℃ | 终止温度T2/℃ | 平均温度差T2-T1/℃ | △H | ||
| 盐酸 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 29.2 | ------- | ------- |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | ||
| 3 | 26.4 | 26.2 | 26.3 | 29.5 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的简单离子半径比X的简单离子半径大 | |
| B. | 化合物Y2Z中既有离子键、又有共价键 | |
| C. | Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝 | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:HmZ、HnW、HpX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com