
【题目】下列说法正确的是
A. 丙烯中所有原了共平面
B. 葡萄糖、花生油和蚕丝一定条件下都能发生水解反应
C. 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
D. C4H4仅有 和CH≡C-CH=CH2两种同分异构体
和CH≡C-CH=CH2两种同分异构体
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】H2C2O4(乙二酸),俗名草酸,存在于自然界的植物中。已知常温下草酸电离平衡常数K1=5.0×10-2,K2=5.4×10-5,碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。Ksp (CaC2O4)=2.3×10-9,Ksp(CaCO3)=2.5×10-9。回答下列问题:
(1)写出草酸溶液中存在的主要电离反应方程式_____________________________________。
(2)长期将豆腐与菠菜混合食用,容易损失钙素且患胆结石疾病。理由是______________________。
(3)25℃,物质的量浓度均为0.1mol/L 的Na2C2O4溶液的pH比Na2CO3溶液pH_________(填“大”“ 小”或“相等”)。将上述两种溶液等体积混合后,滴加CaCl2溶液,当C2O42- 沉淀完全时,CO32-是否沉淀完全_______________(填“是”或“否”)
(4)写出NaHC2O4溶液中水解反应的离子方程式________________________________,计算常温下该反应的水解平衡常数为_____________________,NaHC2O4溶液的pH____7 (填“>”、“<”或“=”)
(5)向盛有饱和草酸溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的紫红色褪去,写出该反应的离子方程式________________________________________。
(6)设计实验证明草酸的酸性比碳酸强________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
(1)还原剂是________,还原产物__________。
(2)浓硝酸在反应中表现出来的性质是________________。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3)当有9.6g铜参与反应时,在标准状况下,产生气体的体积为________,转移的电子数为___________。
(4)用双线桥法标出电子转移的方向和数目______。
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )

A.通电后阳极区溶液pH增大
B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O
C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成
D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。
(1)已知反应CO(g)+2H2(g)== CH3OH(g) H= —99kJ.mol—1中的相关化学键键能如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | x | 465 | 413 |
则x=___________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) ,
CH3OH(g) ,
CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(b)____v(a)(填“>”、“<”或“=”)。②该反应的△S______0,图中的T1______T2(填“>”、“<”或“=”)。
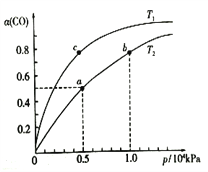
③该合成反应的温度一般控制在240~270℃,选择此温度范围的原因是:
I.此温度范围下的催化剂活性高;
II.______________________________________________________。
④图中a点的压强平衡常数KP=_______________(KPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
II:CO2(g)+H2(g) ![]() CO(g) + H2O(g) H2
CO(g) + H2O(g) H2
III:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) H3
CH3OH(g) + H2O(g) H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如下图所示。
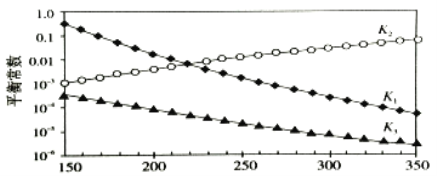
则H1___________H3(填“>”、“<”或“=”), 理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。
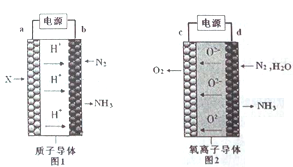
下列说法错误的是
A. a电极上通入的物质是H2
B. 电解池中b是阳极,c是阴极
C. d电极上电极反应式是N2+3H2O+6e-=2NH3+3O2-
D. 若I=2.0A,通电1h,理论上两装置均可得NH3的质量为![]() 。(已知一个电子的电量为1.6×10-19C)
。(已知一个电子的电量为1.6×10-19C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液中NH4+和NH3·H2O的物质的量分数φ与加入盐酸的体积V及混合液pH变化的关系如图所示,下列说法正确的是

A. 表示NH3·H2O物质的量分数变化的曲线是B
B. pH=9.26时的溶液中,NH3·H2O的电离程度小于NH4+的水解程度
C. 常温下,NH3·H2O的电离常数为1.8×10-5mol/L(已知lg1.8=0.26)
D. 当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5+10-9)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO47H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是:__________(填字母序号)。
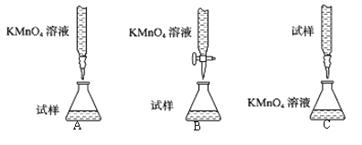
②该小组拟在同浓度的FeSO4溶液中,探究酸性KMnO4溶液浓度对Fe2+被氧化时反应速率的影响。限选试剂与仪器:0.10molL-1FeSO4、0.02molL-1酸性KMnO4、蒸馏水、锥形瓶、试管、胶头滴管、量筒、秒表。参照下表格式,完成实验表格(列出所选试剂体积和数据;数据用字母表示)。_____________、_____________、_____________、_____________。

(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如图所示。
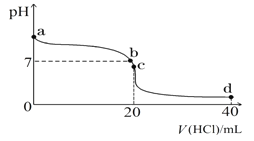
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)=__________________。
②取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释:___________________________________。
③d点所示溶液中离子浓度由大到小的排序是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或做法正确的是
A.实验室常用加热氯化铵固体来制备氨气
B.铵盐很稳定,受热不易分解
C.浓硝酸不稳定,应用棕色的细口瓶盛放
D.正常雨水pH等于7,酸雨的pH小于7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com