
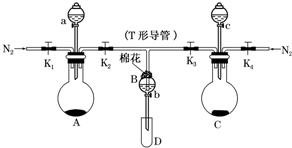
 某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).分析 (1)检查装置气密性,首先要密闭,应关闭a、b、K1、K3,打开K2,向B装置中加水,T形导管下端插入水中,微热A装置,根据是否看到气泡及停止加热恢复室温,T形导管下端是否形成一段水柱进行判断;
(2)氯气、二氧化硫有毒,需要用用碱溶液吸收;装置中氧气干扰实验,则通入一段时间N2的目的排出装置中的空气;
(3)氯气将氯化亚铁中的Fe2+氧化为Fe3+,可用硫氰化钾可以证明其中含有Fe3+;A装置中氯离子被酸性高锰酸根离子氧化成氯气,据此写出反应的离子方程式;
(4)Fe3+被SO2还原为Fe2+,亚铁离子的溶液为浅绿色;B中铁离子将二氧化硫氧化成硫酸,据此写出离子方程式;
(5)结合实验现象及氧化还原反应原理判断Cl2、Fe3+和SO2的氧化性由弱到强的顺序.
解答 解:(1)检查装置气密性,首先要密闭,应关闭a、b、K1、K3,打开K2,向B装置中加水,T形导管下端插入水中,微热A装置,看到有气泡产生,停止加热恢复室温,T形导管下端形成一段水柱,说明A装置气密性良好,
故答案为:关闭a、b、K1、K3,打开K2,向B装置中加水,将T形导管下端插入水中,微热A装置,看到有气泡产生,停止加热恢复室温,T形导管下端形成一段水柱,说明A装置气密性良好;
(2)用碱溶液吸收多余的氯气、二氧化硫,防止污染空气;通入一段时间N2的目的是排出装置中的空气,防止其干扰实验,
故答案为:NaOH;排出装置中的空气,防止其干扰实验;
(3)氯气将氯化亚铁中的Fe2+氧化为Fe3+,Fe3+遇KSCN溶液变为血红色,则用硫氰化钾可以证明其中含有Fe3+;A装置中酸性条件下高锰酸根离子将氯离子氧化成氯气,反应的离子方程式为:2MnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O,
故答案为:硫氰化钾;2MnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O;
(4)Fe3+被SO2还原为Fe2+,溶液变为浅绿色;B中二氧化硫被铁离子氧化成硫酸,反应的离子方程式为:SO2+2Fe3++2H2O═2Fe2++SO42-+4H+,
故答案为:浅绿;SO2+2Fe3++2H2O═2Fe2++SO42-+4H+;
(5)结合实验现象及氧化还原反应原理可知:Cl2、Fe3+和SO2的氧化性由弱到强的顺序为:SO2<Fe3+<Cl2,
故答案为:SO2<Fe3+<Cl2.
点评 本题考查了性质实验方案的设计,题目难度中等,涉及氧化还原反应中氧化性、还原性强弱判断、化学实验基本操作方法应用、性质方案设计与评价等知识,明确实验目的及反应原理为解答关键,试题培养了学生的分析能力及化学实验能力.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ①②⑤ | C. | ③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(s) | B. | CH3COONa(s) | C. | FeCl3(s) | D. | NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 16g | B. | 8g | C. | 40g | D. | 0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
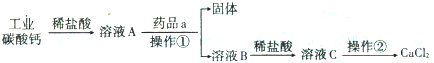
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
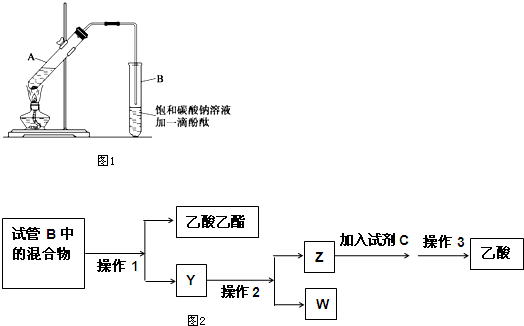
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯净物C4H8的核磁共振氢谱峰最多为4 | |
| B. | 化学式为C8H8的有机物,一定能使酸性高锰酸钾溶液褪色 | |
| C. |  的同分异构体中,可以有醇、酚类物质 的同分异构体中,可以有醇、酚类物质 | |
| D. | 1 mol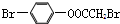 最多能与2 mol NaOH反应 最多能与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、纤维、油脂、淀粉、聚乙烯都是高分子化合物 | |
| B. | 蛋白质的水解产物为氨基酸 | |
| C. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| D. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com