
液态锂离子电池是Li+嵌入化合物的二次电池。正极采用锂化合物LiCoO2,负极采用碳电极,充电后成为锂-碳层间化合物LixC6(0<x≤1),电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液。下列有关说法错误的是
A.LiCoO2改写为氧化物的形式为:Li2O·Co2O3
B.该电池的电解液使用有机溶剂主要是由于有机溶剂与锂盐有很好的互溶性
C.该电池充电时的反应为:Li++6C+xe—=LixC6+(1-x)Li+
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×
10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法正确的是 ( )。
A.25 ℃时,0.1 mol·L-1 HF溶液的pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中,Ksp(CaF2)=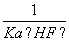
D.该体系中有CaF2沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
A.采用较高压强(20~50 MPa)
B.采用500 ℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔
中,并补充N2和H2
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
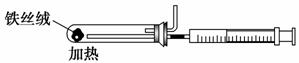
(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924
kJ,原因是_________________________________________________________
_________________________________________________________________。
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。
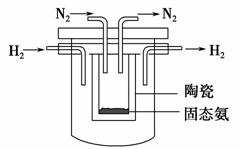
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 20mL 10mol·L-1的浓硝酸或浓硫酸与足量铜加热反应转移电子数均为0.2NA
B. 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA
C. 在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA
D. 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
配制100mL 1 mol·L-1的NaOH溶液,下列操作中错误的是
A.在托盘天平上放两张大小相等的纸片,然后将NaOH固体放在纸片上进行称量
B.把称得的NaOH放入适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中
C.用蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也移入容量瓶中
D.距刻度1—2cm时,用胶头滴管加入蒸馏水,直到液体凹面最低点恰好与刻度相切
查看答案和解析>>
科目:高中化学 来源: 题型:
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)
 qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com