
| A. | CaO+H2O═Ca(OH)2 | B. | 2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO | ||
| C. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | D. | Cu(OH)2 $\frac{\underline{\;△\;}}{\;}$CuO+H2O |
分析 氧化还原反应的特征是元素化合价的升降,可根据元素化合价的变化解答该题.
解答 解:A.为化合反应,元素化合价没有发生变化,不属于氧化还原反应,故A错误;
B.2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO为化合反应,元素化合价发生变化,属于氧化还原反应,故B正确;
C.为复分解反应,元素化合价没有发生变化,不属于氧化还原反应,故C错误;
D.为分解反应,元素化合价没有发生变化,不属于氧化还原反应,故D错误.
故选B.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:填空题
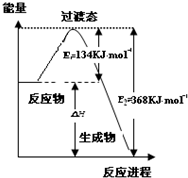 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-a}{b}$ | B. | $\frac{2(b-a)}{b}$ | C. | $\frac{3a-2b}{b}$ | D. | $\frac{2b-3a}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
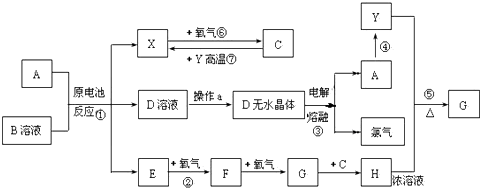
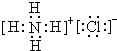
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
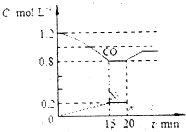 CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题
CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
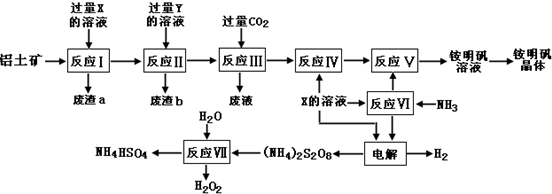
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
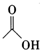 +
+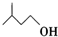 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ 
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60 mL | B. | 90 mL | C. | 120 mL | D. | 45 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com