
分析 吗啡分子含C:71.58%、H:6.67%、N:4.91%、其余为O,可知O的质量分数为16.84%,其相对分子质量不超过300,分子中N原子最大数目=$\frac{300×4.91%}{14}$=1.05,故吗啡分子中含有1个N原子,进而计算吗啡的相对分子质量,计算吗啡分子中C、H、O原子数目确定其分子式.
解答 解:(1)吗啡分子含C:71.58%、H:6.67%、N:4.91%、其余为O,可知O的质量分数为16.84%,其相对分子质量不超过300,分子中N原子最大数目=$\frac{300×4.91%}{14}$=1.05,故吗啡分子中含有1个N原子,则吗啡的相对分子质量=$\frac{14}{4.91%}$=285,
故答案为:285;
(2)吗啡分子中C原子数目=$\frac{285×71.58%}{12}$=17,H原子数目=$\frac{285×6.67%}{1}$=19,O原子数目=$\frac{285×16.84%}{16}$=3,吗啡分子中含有1个N原子,故吗啡的分子式为:C17H19NO3,
故答案为:C17H19NO3.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,确定N原子数目是关键,难度中等.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:填空题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与苯酚都能与溴水发生取代反应 | |
| B. | 苯酚与苯甲醇(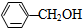 )组成相差一个-CH2-原子团,因而它们互为同系物 )组成相差一个-CH2-原子团,因而它们互为同系物 | |
| C. | 在苯酚溶液中,滴入几滴FeCl3溶液,溶液立即呈紫色 | |
| D. | 苯酚分子中由于羟基对苯环的影响,使苯环上5个氢原子都容易取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Cl-CH2-CH2Cl | B. | CHCl2-CH2-CH3 | C. | CH2Cl-CHCl-CH3 | D. | CH3-CCl2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与1molCl2反应时转移的电子数为3NA | |
| B. | pH=1的H2SO4溶液,含H+的数目为NA | |
| C. | 273K、101kPa下,28g乙烯与丙烯混合物中含有氢原子总数数目为2NA | |
| D. | 2g H218O与D216O的混合物中所含中子、电子数目均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定没有甲烷 | B. | 混合气体中一定有甲烷和乙烯 | ||
| C. | 混合气体中可能有乙烯 | D. | 混合气体中一定有乙炔和丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 上述反应是吸热反应 | |
| B. | 实验1达平衡时,CO的转化率为70% | |
| C. | 实验2达平衡时,a<7.0 | |
| D. | 实验3达平衡后,再充入1.0 mol H2,K值增大,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素的原子序数越大,其原子半径越大 | |
| B. | 在元素周期表中,元素所在的周期数等于原子核外电子数 | |
| C. | 最外层电子数为8的微粒是稀有气体元素的原子 | |
| D. | 在元素周期表中,元素所在族的族序数等于原子核外最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com