
分析 (1)在5NH4NO3═2HNO3+4N2↑+9H2O的反应中,氮元素由铵根中-3价升高为0价,被氧化;氮元素由硝酸根中+5价降低为0价,被还原,氮气既是还原产物也是氧化产物,根据电子转移守恒计算被氧化的氮原子与被还原的氮原子;
(2)Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4中部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,根据电子转移是计算被CuSO4氧化的P4的物质的量;
(3)CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,反应生成SCN-与SO32-.
解答 解:(1)5NH4NO3═2HNO3+4N2↑+9H2O的反应中,氮元素由铵根中-3价升高为0价,被氧化,氮元素由硝酸根中+5价降低为0价,被还原,根据电子转移守恒,可知被氧化的氮原子与被还原的氮原子物质的量之比为(5-0):[0-(-3)]=5:3,则被氧化和被还原的氮元素质量之比为5:3,
故答案为:5:3;
(2)Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4中部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若6molH3PO4生成,则参加反应CuSO4为6mol×$\frac{60}{24}$=15mol,根据电子转移守恒,被CuSO4氧化的P4的物质的量为$\frac{15mol×1}{4×5}$=0.75mol,
故答案为:0.75;
(3)CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,反应生成SCN-与SO32-,反应离子方程式为:CN-+S2O32-=SCN-+SO32-,
故答案为:CN-+S2O32-=SCN-+SO32-.
点评 本题考查氧化还原反应的计算,把握反应中元素的化合价变化为解答的关键,侧重电子守恒计算的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
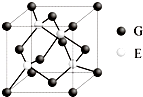 现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题:
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | CuO | C. | CuSO4•5H2O | D. | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国规定商家不得无偿提供塑料袋,目的是减少“白色污染” | |
| B. | 乙醇是一种易燃烧污染小的可再生能源,但只能在实验室内作燃料 | |
| C. | 化石燃料不可再生,使用太阳能代替化石燃料,有利于节约资源、保护环境 | |
| D. | 积极开发废电池的综合利用技术,防止其中的重金属盐对土壤和水源造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2 是氧化剂,PtF6 是还原剂 | |
| B. | O2(PtF6)中氧元素的化合价为+1 | |
| C. | O2(PtF6)中不存在共价键 | |
| D. | 每生成1mol O2(PtF6)则转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com