
| A. | FeS2既是氧化剂,又是还原剂 | |
| B. | FeSO4溶液保存过程中需加稀硫酸和铁粉,防止变质 | |
| C. | 每生产1molFeSO4,转移的电子数为28NA | |
| D. | 硫酸工业中煅烧黄铁矿,其氧化产物只有SO2 |
分析 A.依据反应中各元素化合价变化判断,氧化剂还原剂;
B.防止亚铁离子氧化,并抑制水解;
C.2FeS2+7O2+2H2O=2FeSO4+2H2SO4,氧气为氧化剂,依据7mol氧气参加反应转移28mol电子,据此计算;
D.黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4.
解答 解:A.依据方程式2FeS2+7O2+2H2O=2FeSO4+2H2SO4可知:反应中FeS2中铁元素化合价不变,硫元素化合价升高,所以FeS2是还原化剂,故A错误;
B.防止亚铁离子氧化,并抑制水解,则配制FeSO4溶液时,需加入少量铁粉和稀硫酸,故B正确;
C.2FeS2+7O2+2H2O=2FeSO4+2H2SO4,氧气为氧化剂,7mol氧气参加反应生成2mol硫酸亚铁转移28mol电子,则生成1mol硫酸亚铁转移14mol电子,故C错误;
D.黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4,反应中FeS2化合价都升高,所以SO2和Fe3O4都是氧化产物,故D错误;
故选:B.
点评 本题考查了氧化还原反应,准确判断反应各元素化合价变化及氧化还原反应得失电子守恒是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | |
| B. | 若铁粉过量,充分反应后溶液由蓝色变为棕黄色 | |
| C. | CuSO4具有氧化性 | |
| D. | 转移0.2mol电子,则固体质量增加了0.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不是所有的烷烃中都既有极性键,又有非极性键 | |
| B. | 所有的烯烃中都是既有极性键,又有非极性键 | |
| C. | 在CCl4中碳元素呈现+4价 | |
| D. | 有机化学反应只能发生在极性键上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH | B. | KAl(SO4)2 | C. | KHCO3 | D. | K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
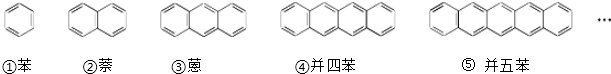
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极得电子反应产物是Mn2O3(s) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
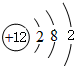 、
、 ,C的离子结构示意图
,C的离子结构示意图
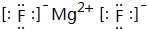 化学键类型为离子键.
化学键类型为离子键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和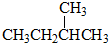
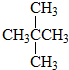 和
和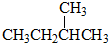
| 类别 | 同位素 | 同素异形体 | 同系物 | 同分异构体 |
| 组号 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com