
| A. | 仅① | B. | 仅①② | C. | 仅①②③ | D. | ①②③④ |
分析 Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,且硫离子第一步水解程度远远大于第二步水解程度,该溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断离子浓度大小.
解答 解:①Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,且硫离子第一步水解程度远远大于第二步水解程度,硫离子两步水解和水电离都生成氢氧根离子,硫离子第一步水解生成硫氢根离子,所以该溶液中离子浓度大小顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故正确;
②该物质溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故正确;
③根据物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),故正确;
④根据物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),所以得c(OH-)=c(HS-)+c(H+)+2c(H2S),故正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确盐的类型及水解程度是解本题关键,注意电荷守恒和物料守恒的灵活运用,题目难度不大.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 若X的反应速率为0.2 mol•L-1•s-1,则Z的反应速率为0.3 mol•L-1•s-1 | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
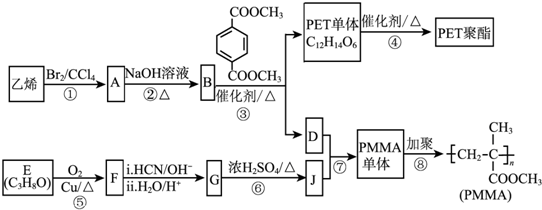
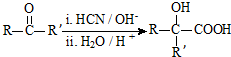 (R、R′代表烃基)
(R、R′代表烃基)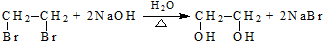 .
.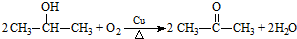 .
.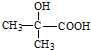 .
.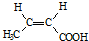 .
.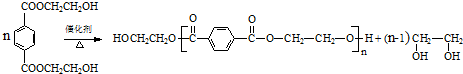 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,对正反应的反应速率影响更大 | |
| B. | 增大压强,对正反应的反应速率影响更大 | |
| C. | 减小反应物浓度,对逆反应的反应速率影响更大 | |
| D. | 加入催化剂,对逆反应的反应速率影响更大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com