
| A. | 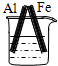 | B. | 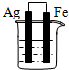 | C. | 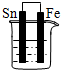 | D. | 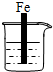 |
分析 先判断装置是原电池还是电解池,再根据原电池正负极腐蚀的快慢和电解池的阴阳极腐蚀快慢来比较,电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答 解:根据图知,A、B、C装置是原电池,在A中,铁做正极,被保护,腐蚀速率变慢;在B和C中,金属铁做负极,负极的腐蚀速率均变快,但B中Ag和铁的活泼性差距较C中的大,故B的腐蚀速率大于C;D装置不能形成原电池,反应速率没被加快,所以腐蚀速率是最快的是B.故选:B.
点评 本题考查了金属的腐蚀与防护,难度不大,注意不同条件下金属腐蚀的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 最终可以生成2 mol NH 3 | |
| B. | 单位时间内,若消耗了0.5mol N2的同时,生成1 mol NH3,则反应达到平衡 | |
| C. | 反应达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1:3:2 | |
| D. | 反应达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol乙烷中共价键总数为6NA | |
| B. | 1mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.1mol丙烯酸中含有双键的数目为0.2NA | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 除去甲苯中的苯甲酸,可以先加入NaOH溶液,充分振荡,然后分液 | |
| B. | 除去C2H5OH中的少量CH3COOH:加足量CaO,蒸馏 | |
| C. | 用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO | |
| D. | 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸将乙酸全部转化为乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学电源名称 | 正极反应式 | 负极反应式 | 电解质溶液pH的变化 |
| 碱性氢氧燃料电池 | O2+2H2O+4e-=4OH- | 此空不用填写 | 变小 |
| 碱性甲烷燃料电池 | 此空不用填写 | CH4+8e-+10OH-=CO32-+7H2O | 变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
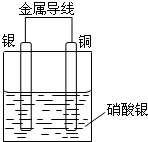 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com