
【题目】今有一混合溶液,只可能含有以下离子中的若干种:Na+、NH4+、Cl-、Ba2+、CO32-、SO42-、OH- , 现取三份各100 mL的溶液进行如下实验(每步实验均仅进行完全),根据实验内容填写相应结论:
(1)第一份加足量NaOH溶液加热后,收集到0.68gNH3气体,原溶液中一定不含有;
(2)第二份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
综合以上实验,原溶液中一定含有、 , 一定不含有;
(3)第三份加入AgNO3溶液有沉淀产生。
原溶液中还一定存在 , 可能存在(若没有,两空均可不填)
【答案】
(1)OH-
(2)SO42;CO32-;Ba2+
(3)Na+;Cl-
【解析】(1)加足量NaOH溶液加热产生气体,气体是氨气,0.68gNH3的物质的量为 ![]() =0.04mol,有铵离子0.04mol,溶液中一定不含有OH- , 所以答案是:OH-;
=0.04mol,有铵离子0.04mol,溶液中一定不含有OH- , 所以答案是:OH-;
(2)第二份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。不溶于盐酸的2.33g为硫酸钡,物质的量为: ![]() =0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,碳酸钡的物质的量为:
=0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,碳酸钡的物质的量为: ![]() =0.02mol,故原溶液中一定存在CO32-、SO42- , 则一定没有Ba2+ , 所以答案是:CO32-、SO42-;Ba2+;
=0.02mol,故原溶液中一定存在CO32-、SO42- , 则一定没有Ba2+ , 所以答案是:CO32-、SO42-;Ba2+;
(3)第三份加入AgNO3溶液有沉淀产生,与AgNO3溶液有沉淀产生的离子有:Cl-、CO32-、SO42-;根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;n(-)=2n(CO32-)+2n(SO42-)=0.06mol,正电荷总物质的量大于负电荷,故原溶液中一定有Na+ , 至少为0.02mol;不能确定是否存在Cl- , 所以答案是:Na+;Cl-。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
B. NH3汽化时吸收大量的热,因此,氨常用作制冷剂
C. CO2、NO2或SO2都会导致酸雨的形成
D. 活性炭、SO2、Na2O2都能使品红溶液褪色,原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用高锰酸钾制取氧气时有如下操作步骤:①加热②检查装置的气密性③装药品④用排水集气法收集⑤从水槽中取出导气管⑥熄灭酒精灯⑦连接仪器。其中操作顺序正确的是( )
A. ①⑦③②⑤④⑥ B. ⑦②③①④⑤⑥
C. ⑤⑦③②①④⑥ D. ⑦③①②④⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对某品牌牙膏中摩擦剂的成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。利用下图所示装置(夹持仪器略去),对该牙膏样品中碳酸钙的含量进行定量测定。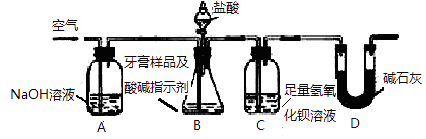
(1)C中反应生成BaCO3的化学方程式是
(2)装置D的作用是
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:
(4)下列各项措施中,不能提高测定准确度的是(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A→B之间增添盛有浓硫酸的洗气装置
d.在B→C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。则样品中碳酸钙的质量分数为
(6)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中既是化合反应又是氧化反应的是( )
A. 氧化钙+水→氢氧化钙 B. 酒精+氧气→二氧化碳+水
C. 氢气+氧气→水 D. 氯化氢+氨气→氯化铵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)硅酸钠的水溶液俗称 , 向碳酸氢钠溶液中滴入1~2滴酚酞溶液,溶液显色。
(2)Fe(OH)3胶体可用作净水剂,取少量Fe(OH)3胶体于试管中,向试管中逐渐滴加稀盐酸至过量,产生的现象为。
(3)实验室盛装NaOH溶液的试剂瓶不能用玻璃塞,以防止发生反应:(离子方程式)。
(4)将Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无残留金属存在,请用两个化学反应方程式表示其变化:
①。
②。
(5)已知:5NH4NO3 ![]() 2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为。
2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组试利用废铝屑(含杂质铁)制备硫酸铝晶体,并对硫酸铝晶体进行热重分析,其主要实验流程如下:
(1)向溶液A中通入过量的CO2 , 发生反应的离子方程式为 。
(2)操作II所包含的实验操作的名称依次为 、冷却结晶、、洗涤、干燥。
(3)若开始时称取的废铝屑的质量为5.00g,得到固体A的质量为0.95g,硫酸铝晶体的质量为49.95g(假设每一步的转化率均为100%),则所得硫酸铝晶体(含有结晶水)的化学式为 。
(4)取以上制得的硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重。其热分解的曲线如下图所示。
已知:失重%= ![]() ×100%
×100%
则失重第一阶段的化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1)取1molL﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示: 
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是 .
②t时间段内,造成其pH发生上述变化,用离子方程式解释是 .
(2)探究Na2SO3溶液与FeCl3溶液实际反应的情况: 实验ⅰ
装置 | 操作 | 现象 |
| 向2mL1molL﹣1FeCl3溶液中,逐滴滴加1moL﹣1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
实验ⅱ
装置 | 操作 | 现象 |
| 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
①实验ⅱ证明,溶液中含有离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ , W溶液中c(Fe2+)一定很大,反应的离子方程式是 .
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色. ①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是 .
②实验过程和结果显示,O2、Fe3+、SO42﹣的氧化性强弱顺序是 .
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是 .
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各组离子一定大量共存的是( )
A.使甲基橙呈红色的溶液中:Na+、AlO2﹣、NO3﹣、CO32﹣
B.c(ClO﹣)=1.0 mol?L﹣1溶液:Na+、SO32﹣、S2﹣、Cl﹣
C.含有0.1 mol?L﹣1 HCO3﹣的溶液:Na+、Fe3+、NO ![]() 、C6H5O﹣
、C6H5O﹣
D.![]() =0.1 mol?L﹣1的溶液:Na+、K+、CO32﹣、NO3﹣
=0.1 mol?L﹣1的溶液:Na+、K+、CO32﹣、NO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com