
下列有关化学反应速率的说法正确的是()
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100mL2mol•L﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
考点: 化学反应速率的影响因素.
专题: 化学反应速率专题.
分析: A.铁在浓硫酸中发生钝化;
B.加入适量的氯化钠溶液,c(H+)减小;
C.无论是放热反应,还是吸热反应,升高温度反应速率都增大;
D.对于气态参加的反应,减小压强,反应速率减小.
解答: 解:A.铁在冷浓硫酸中发生钝化,加热时浓H2SO4与Fe反应不产生H2,故A错误;
B.加入适量的氯化钠溶液,体积增大,c(H+)减小,反应速率减小,故B错误;
C.升高温度,无论是放热反应,还是吸热反应,反应速率都增大,故C错误;
D.减小压强,对有气体参与的反应,反应速率减慢,故D正确.
故选D.
点评: 本题考查影响反应速率的因素,题目难度不大,注意相关基础知识的积累,易错点为A项,注意浓硫酸的性质.


科目:高中化学 来源: 题型:
按要求作答
(1)写出钠和水应的离子方式 ;
(2)写出氯化铝和氨水反应的化学方式 ;
(3)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,离子方程式为 .
(4)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
C、O、Si、Cl、Na、Fe是中学化学中常见的六种元素.
(1)Si位于元素周期表第三周期第ⅣA族,Fe2+的离子结构示意图 ,Cl的基态原子外围电子层排布式为 ;
(2)用“>”或“<”填空:
第一电离能 键能 沸点
O Na H﹣Cl H﹣Si CO2 H2O
(3)氯的一种常见含氧酸有漂白性,它与H2CO3酸性强弱不同,写出可以证明此结论一个化学方程式 ;
(4)黄绿色气体二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.工业上常利用氯酸钠和浓盐酸来制备ClO2,同时还得到一种黄绿色的气体单质、一种无色液体和一种常见离子化合物.写出该反应的化学方程式,并标出电子转移的方向和数目: ;
(5)Ti倍称为继铁铝之后“21世纪”金属,应用前景很广.钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体.在25℃、101KPa下,已知煤消耗7克CO,吸收aKJ热量,该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,在容积为2L的密闭容器中,将2mol 气体M和3mol N气体混合,发生如下反应:2M(g)+3N(g)⇌x Q(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4mol/L,下列有关叙述正确的是()
A. x值为2 B. 混合气体的密度增大
C. 平衡时N的浓度为0.3 mol/L D. N的转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是()
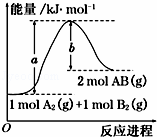
A. 该反应热△H=+(a﹣b) kJ•mol﹣1
B. 每生成2mol AB(g)吸收b kJ
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源.氢氧燃料电池的突出优点是把化学能直接转化为电能,而不经过热能中间形成,发生的反应为:2H2+O2 2H2O
2H2O
(1)则负极通的应是H2,负极反应式为 正极反应式为 .
(2)如把KOH改为稀硫酸作导电物质,则负极反应式为 ,
(3)如把H2改为CH4,KOH作导电物质,则负极反应式为 .
(4)写出惰性电极电解以下溶液的总反应的化学方程式
①NaCl溶液
②CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事故的处理方法正确的是()
A. 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
B. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
C. 皮肤上溅有较多的浓硫酸,赶紧用水冲洗
D. 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在中性条件下钢铁易发生吸氧腐蚀时,正极上发生的电极反应是()
A. 2H++2e﹣→H2 B. Fe2++3e→Fe
C. 2H2O+O2+4e﹣→4OH﹣ D. Fe3+﹣e→Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com