
【题目】镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是
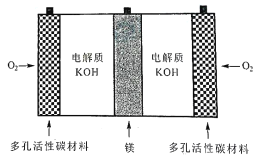
A. 放电时,外电路电子由镁电极流向多孔碳材料电极
B. 放电时,正极的电极反应式为O2+ 4e—+ 2H2O =4OH
C. 理论上,外电路中流过2 mol电子时,负极质量增加58 g
D. 电池反应产物Mg(OH)2经过灼烧与还原可制成镁锭循环利用
【答案】C
【解析】
先根据题目叙述和对应的示意图,判断出电池的正负极,再根据正负极的反应要求进行电极反应方程式的书写。
A、通氧气的电极为正极,因为多孔碳电极为正极,放电时,外电路电子由镁电极流向多孔碳材料电极(由负极流向正极),选项A正确;
B. 放电时,多孔碳电极为正极,碱性条件下正极上氧气得电子产生氢氧根离子,电极反应式为O2+ 4e-+ 2H2O =4OH-,选项B正确;
C、根据负极反应式:Mg-2 e-+ 2 OH═Mg(OH)2,当外电路流过2mol电子时,负极质量增加34 g,选项C错误;
D. 电池反应产物Mg(OH)2经过灼烧得到氧化镁,再还原可制成镁锭循环利用,选项D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】相同体积的硫酸钠、硫酸镁、硫酸铁溶液分别加入足量的氯化钡溶液,产生相同质量的沉淀,则三种溶液的物质的量浓度之比为( )
A.1:1:3B.1:2:3C.3:3:1D.6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol 甲烷与氯气发生取代反应,待反应完全后测知四种取代物物质的量相同,测消耗的氯气有( )
A.2mol B.10mol C.7.5mol D.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A. D原子的简化电子排布式为[Ar]3s23p4
B. B、C两元素的第一电离能大小关系为B>C
C. 用电子式表示AD2的形成过程为![]()
D. 由B60分子形成的晶体与A60相似,分子中总键能:B60>A60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1L0.3mol L1HA溶液与0.1molNaOH固体混合,使之充分反应得到溶液(a)。然后向该溶液中通入HCl或加入NaOH固体(忽略体积和温度变化),溶液pH随通(加)入物质的量的变化如图。下列叙述错误的是

A. HA是一种弱酸
B. 向a点对应溶液中通入HCl,充分反应后,c(H+)/c(HA)增大
C. b点对应溶液中:c(Na+)=c(Cl-)>c(HA)>c(H+)>c(OH-)
D. c点对应溶液中:c(Na+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铷的叙述正确的是( )
A. 它位于周期表中第4周期
B. 氢氧化铷是弱碱
C. 在钠、钾、铷三种单质中,铷的熔点最高
D. 硝酸铷是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组的三种物质中,两边的固体均有导线连接,插入中间的液体中,其中能组成原电池的是
A. Zn | H2SO4(稀) | CB. Cu | 酒精 | Ag
C. Zn | CCl4 | CuD. Fe | H2SO4(稀) | Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钒(VO2)是一种新型热敏材料。+4价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:

回答下列问题:
(1) VOC12中V的化合价为 ________。
(2)步骤i中生成VOC12的同时生成一种无色无污染的气体,该化学方程式为___。也可只用浓盐酸与V2O5来制备VOC12溶液,该法的缺点是 _______
(3)步骤ii可在下图装置中进行。
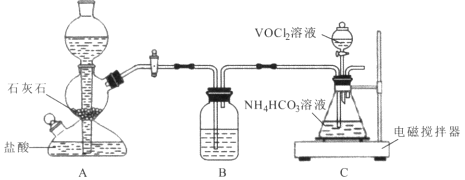
①反应前应通入CO2数分钟的目的是 ________。
②装置B中的试剂是____。
(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量ag样品于锥形瓶中,用20mL蒸馏水与30 mL混酸溶解后,加0.02 mol/LKMnO4溶液至稍过量,充分反应后继续加1 %NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用c mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为:VO2++Fe2++2H+= VO2++Fe3++H2O.
①KMnO4溶液的作用是_______ 。NaNO2溶液的作用是______ 。
②粗产品中钒的质量分数的表达式为_________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com