
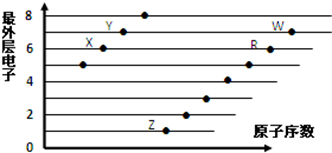
| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的酸性:X>Y | |
| D. | X、Z形成的化合物中阴阳离子个数比为1:2 |
分析 都是短周期元素,由最外层电子数与原子序数关系可知,X、Y处于第二正确,X的最外层电子数为6,故X为O元素,Y的最外层电子数为7,故Y为F元素;Z、R、W处于第三周期,最外层电子数分别为1、6、7,故Z为Na元素、R为S元素、W为Cl元素,据此进行解答.
解答 解:都是短周期元素,由最外层电子数与原子序数关系可知,X、Y处于第二正确,X的最外层电子数为6,故X为O元素,Y的最外层电子数为7,故Y为F元素;Z、R、W处于第三周期,最外层电子数分别为1、6、7,故Z为Na元素、R为S元素、W为Cl元素,
A.X为氧元素、R为硫元素,二者处于同一主族,故A错误;
B.同周期自左而右,原子半径减小,电子层越多原子半径越大,故原子半径S>Cl>O,故B错误;
C.X为O元素,其氢化物为水,Y为F元素,其氢化物为HF,氢化物的酸性:Y>X,故C错误;
D.X、Z形成的化合物为氧化钠和过氧化钠,两者中阴阳离子个数比为1:2,故D正确;
故选D.
点评 本题考查结构性质位置关系、元素周期律等,难度不大,根据最外层电子数及原子序数的关系确定元素是解题的关键,注意整体把握元素周期表的结构.


科目:高中化学 来源: 题型:选择题
| A. | NaOH的电子式: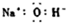 | B. | I4O9(碘酸碘)中碘的化合价为+3,+5 | ||
| C. | NH5的结构式为: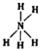 | D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 分子式:C10H20 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应和取代反应 | D. | 所有碳原子均在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
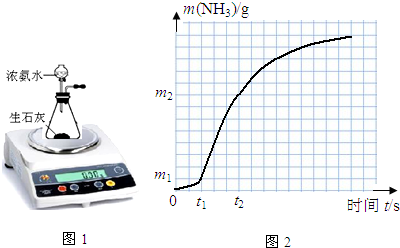
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | ||
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 30 | 粉末状 | ||
| 实验2 | 30 | ||||
| 实验3 | 40 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | V | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
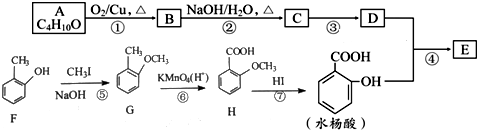
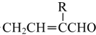
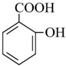 →
→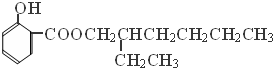 +H2O;
+H2O;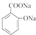
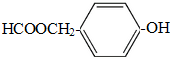 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
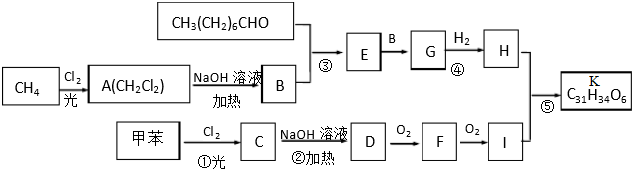
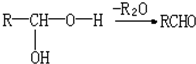
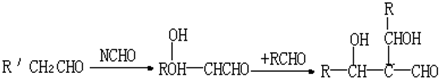
 .
.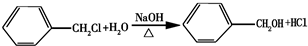
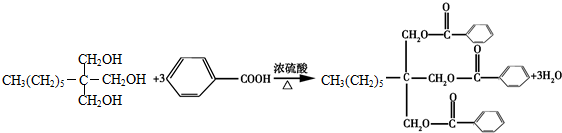
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 | +3 | +1 | +1 |
| A. | 氢化物稳定性的强弱:b>d | |
| B. | 金属性的强弱:f<g | |
| C. | 元素e的氧化物只能与酸反应 | |
| D. | 最高价氧化物对应的水化物的碱性:e<g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com