
一定条件下,利用如图装置可实现有机物的储氢,下列有关说法正确的是( )

A. 苯在电极D放电时断开的化学键是极性键
B. 气体X在反应中通常体现还原性
C. 若阳极区的电解质溶液为稀硫酸,则电解一段时间后,阳极区溶液的pH增大
D. 电极D的电极反应式为C6H6+6H++6e-===C6H12
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:2016-2017学年安徽省安庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列物质互相反应,反应产物随两种物质的用量不同而不同的是
①铁与氯气 ②氢氧化钠与二氧化碳 ③铁与稀硝酸 ④铜与硫粉
⑤盐酸与碳酸钠 ⑥氯化铝与浓氨水 ⑦硫化氢与氧气
A. ②③⑤⑦ B. ②③⑤⑥⑦
C. ①②③⑤⑥⑦ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三高考适应性月考(六)理综化学试卷(解析版) 题型:填空题
[化学-选修3:物质结构与性质]
硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是_________________。
(2)①硫单质的一种结构为 ,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
②SO42-、CS2、CO32-键角由大到小的顺序是_________________。
(3)含硫的物质的特殊性质与其结构相关。
①熔点:SF6 _______A1F3(填“>”或“<”),原因是___________________。
②分析并比较 与
与 的沸点高低:___________________。
的沸点高低:___________________。
(4)ZnS晶胞如图所示:

①由图可知,Zn2+填在了S2-形成的______________空隙中。
②已知晶胞密度为, g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
查看答案和解析>>
科目:高中化学 来源:2017届云南省昆明市新课标高三月考卷(六)理综化学试卷(解析版) 题型:选择题
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图所示。下列有关说法正确的是
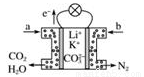
A. a为空气,b为CH4
B. CO32-向正极移动,K+、Li+向负极移动
C. 负极电极反应式为CH4-8e-+4CO32-=5CO2+2H2O
D. 正极电极反应式为O2+4e-+2H2O=4OH
查看答案和解析>>
科目:高中化学 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:简答题
[化学—选修3:物质结构与性质]
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
⑴写出基态Zn原子的价电子排布式__________,基态S原子核外未成对电子数为_____。
⑵ZnSO4中三种元素的电负性由大到小的顺序为_____________________,SO42-的立体构型为________________,其中S的杂化轨道类型为_________。
⑶硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有___________。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
⑷根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为___________;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
⑸立方ZnS晶体的密度为ρg·cm-3,其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。

查看答案和解析>>
科目:高中化学 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:选择题
现代生活需要人们有一定的科学素养,下列有关化学的科学常识正确的是
A. 铝的钝化、煤的气化、漂白粉杀菌消毒过程均有化学反应发生
B. 碳酸钠可用于治疗胃酸过多、制备食品发酵剂
C. 浓硫酸可刻蚀石英制艺术品
D. 氢氧化铁溶胶、淀粉溶液、NaCl溶液均具有丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
0.5mol某气态烃能与1molHCl发生加成反应,生成氯代烷,0.5mol此氯代烷可与3mol氯气发生完全的取代反应,则该烃可能为
A. 乙烯 B. 丙烯 C. 乙炔 D. 丙炔
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省揭阳市高二下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是_______。试写出制备金属钠的化学方程式_____________。金属钠可用于________________(写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:

①正极的电极反应式为_______,电池工作时物质A可循环使用,A物质的化学式为_______。
②请写出检验Na2CO3中钠元素的方法_________________________。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是_________,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为_______。
②已知几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,_______(填离子符号)先沉淀,Ksp_______Ksp(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
下列有关化学用于表述正确的是
A. 质子数和中子数均为6的碳原子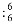 C B. 溴化铵的电子式:
C B. 溴化铵的电子式: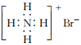
C. 氢氧化钠的电子式: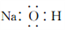 D. 2-丙醇的结构简式:
D. 2-丙醇的结构简式: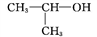
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com