
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2s内的平均反应速率υ(CO2)=3.75×10-4mol•L-1•s-1 | |
| B. | 使用催化剂可以提高单位时间内CO和NO的处理量 | |
| C. | 若将容积缩小为原来的一半,CO平衡转化率大于25% | |
| D. | 若温度降低,该反应的平衡常数增大,则该反应的△H>0 |
分析 A.由表中数据可知υ(CO),由方程式可知υ(CO2)=υ(CO);
B.加入催化剂,可增大反应速率;
C.计算CO的转化率,增大压强,平衡正向移动;
D.温度降低,该反应的平衡常数增大,说明平衡正向移动.
解答 解:A.由表中数据可知υ(CO)=$\frac{(3.60-2.85)×1{0}^{-3}mol/L}{2s}$=3.75×10-4mol•L-1•s-1,由方程式可知υ(CO2)=υ(CO)=3.75×10-4mol•L-1•s-1,故A正确;
B.加入催化剂,可增大反应速率,则可以提高单位时间内CO和NO的处理量,故B正确;
C.CO的转化率为$\frac{3.60-2.70}{3.60}×100%$=25%,增大压强,平衡正向移动,则转化率增大,所以将容积缩小为原来的一半,CO平衡转化率大于25%,故C正确;
D.温度降低,该反应的平衡常数增大,说明平衡正向移动,则正反应为放热反应,故D错误.
故选D.
点评 本题考查化学平衡计算,为高频考点,侧重于学生的分析、计算能力的考查,本题注意把握化学平衡的影响因素、反应速率计算与含义等,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有分子数为1NA | |
| B. | 常温常压下,224LH2和O2的混合气体所含分子数为NA | |
| C. | 通常状况下,1molCl2与足量Na反应转移电子数为NA | |
| D. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 实际应用 |
| A | 氧化铝的熔点高 | 作耐火材料 |
| B | 铁比铜金属活动性强 | 氯化铁溶液腐蚀铜刻制印刷电路板 |
| C | 硅胶多孔,吸水强 | 作袋装食品的干燥剂 |
| D | 金属化合物灼烧有特殊颜色 | 作节日燃放的烟花 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
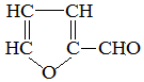 ),糠醛是重要的化工原料,用途广泛.关于糠醛的说法,不正确的是( )
),糠醛是重要的化工原料,用途广泛.关于糠醛的说法,不正确的是( )| A. | 其核磁共振氢谱有3种不同类型的吸收峰 | |
| B. | 1 mol糠醛可与3 mol H2 发生加成反应 | |
| C. | 可与新制的Cu(OH)2浊液在加热时反应生成红色沉淀 | |
| D. | 与苯酚在一定条件下反应得到结构简式为 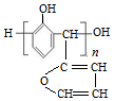 的产物 的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
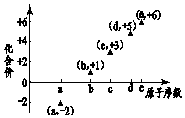 图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d互为同素异形体 | B. | 气态氢化物的稳定性:a>d>e | ||
| C. | 工业上常用电解法制备单质b和c | D. | a和b形成的化合物不可能含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成反应、取代反应 | B. | 加成反应、消去反应 | ||
| C. | 氧化反应、加成反应 | D. | 消去反应、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CaCl2溶液中通入SO2气体 | B. | 向Ba(OH)2溶液中通入过量CO2气体 | ||
| C. | 向FeCl2溶液中加入过量NaOH溶液 | D. | 向Al2(SO4)3溶液中加入过量NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
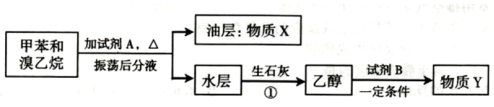
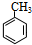 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com