
【题目】能正确表示下列反应的离子方程式是( )
A. 向水中通入氯气:Cl2+H2O2H++Cl﹣+ClO﹣
B. 二氧化锰与浓盐酸反应:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. 碳酸氢钠溶液加过量澄清石灰水:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+2H2O+CO32﹣
D. 金属钠与硫酸铜溶液反应:2Na+2H2O+Cu2+═2Na++Cu(OH)2↓+H2↑
科目:高中化学 来源: 题型:
【题目】用浓盐酸与氯酸钾固体反应制氯气时,发现所得气体颜色偏深,经分析该气体主要含有Cl2和ClO2两种气体,某研究性学习小组拟用如图所示装置分离制得的混合气体,并测定两种气体的物质的量之比。

Ⅰ.查阅资料:
常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不溶于浓硫酸、四氯化碳,有强氧化性,能与NaOH溶液反应生成等物质的量的两种盐,其中一种为 NaClO3。
Ⅱ.制备与分离:
(1)实验加药品前应进行的实验操作是____________。
(2)装置C、E的作用分别是 _________、_________。
(3)F中ClO2与NaOH 溶液反应的离子方程式为_____________。
Ⅲ.测量与计算:
反应结束后,测得B、C装置分别增重 2.0g和 14 .2g,将D中的液体溶于水,配成2.5 L溶液,取 25.00 mL该溶液,调节试样的pH﹤2.0 ,加入足量的 KI晶体,振荡后,静置片刻;加入指示剂X ,用 0.200mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25.00 mL 。(己知: 2ClO2+8H++10I-===5I2+2Cl-+4H2O;2Na2S2O3+I2===Na2S4O6 +2NaI )
(4)指示剂X为_____,滴定终点时的现象是_______________。
(5)原装置收集到的ClO2物质的量为___________。
Ⅳ.结论:
(6)浓盐酸与氯酸钾固体反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 碳酸钙与足量浓硝酸反应:CaCO3+2H+![]() Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
B. 氢氧化钠溶液与稀醋酸反应:OH-+H+![]() H2O
H2O
C. 氯化铝溶液与过量氨水反应: A13++3OH-=A1(OH)3↓
D. 钠与水反应:Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 Q、W、X、Y、Z原子序数依次增加,其中Q、W原子核外L 电子层的电子数分别为0、4,X、Y、Z在周期表中的位置如图所示。 下列说法不正确的是
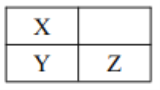
A. W、 X、 Q 的原子半径依次减小 B. Y 的最高价氧化物的水化物一定是强酸
C. W 和 Z 可能形成化合物W3Z8 D. Q、 X、 Z 可能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为中学化学常见的单质或化合物,其中A、F为单质,常温下,E的浓溶液能使铁、铝钝化,相互转化关系如图所示(条件已略去)。完成下列问题:
(1)若A为淡黄色固体,B为气体,F为非金属单质。
①写出E转变为C的化学方程式_____。
②B在空气中能使银器表面失去金属光泽、逐渐变黑,反应的化学方程式为_____。
(2)若B为能使湿润的红色石蕊试纸变蓝的气体。
①A的电子式为_____。
②做过银镜反应后的试管可用E的稀溶液清洗,反应的离子方程式为_____。
③在干燥状态下,向②反应得到的溶质中通入干燥的氯气,得到N2O5和一种气体单质,写出反应的化学方程式_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E;其中,A、C同周期,B、C同主族;A与B 形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)画出元素C的原子结构示意图:________。
(2)写出元素D在元素周期表中的位置:第____周期,第____族;该元素形成的单质的结构式为______。
(3)写出下列物质的电子式:A、B、E形成的化合物______;D、E形成的化合物______。
(4)D、E形成的化合物受热蒸发,吸收的热量用于克服________。
(5)A、B两元素组成的化合物A2B2属于______(填“离子”或“共价”)化合物,其存在的化学键有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素为周期表前20号元素且原子序数依次增大,其中只有A、D为非金属元素。A的气态氢化物溶于水得到的溶液能使酚酞溶液变红。B、C、D的最高价氧化物对应水化物相互之间能够两两反应,且D原子最外层电子数是C原子最外层电子数的2倍。B、E元素同主族。
(1)E在元素周期表中的位置:____________,写出E的最高价氧化物对应水化物与C的单质反应的化学方程式:___________________________________。
(2)A的气态氢化物溶于水后的电离方程式为________________________________。
(3)B单质在空气中燃烧后的产物的电子式为____________,产物中存在的化学键类型有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是25℃时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
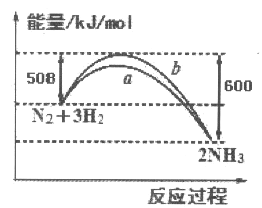
A. 该反应为放热反应
B. b曲线是表示加入了催化剂时的能量变化曲线
C. 加入催化剂,增加了反应的热效应
D. 反应开始通入1 mol N2和3 mol H2,反应后放出的热量一定为92kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com