
 如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是( )
如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是( )| A、Cu片上发生氧化反应 |
| B、电子由Cu片经外电路流向Zn片 |
| C、盐桥中的Cl-移向ZnSO4溶液 |
| D、一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在Na2O、Na2O2中,阳离子和阴离子个数比分别是2:1和1:1 |
| B、常温常压下,11.2L SO2气体中含有的分子数为0.5NA |
| C、一定条件下,密闭容器充入1mol N2和3mol H2充分反应,转移电子的数目为6NA |
| D、Na2CO3溶液中,若CO32-数目为NA,则Na+数目大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有② | B、①③ | C、②④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质、原子、化合物 |
| B、元素、单质、化合物 |
| C、无机化合物、元素、有机化合物 |
| D、原子核、原子、分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
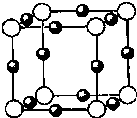 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验方案 | 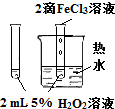 |
 将NO2球浸泡在冰水和热水中 |
 |
 |
| 实验 目的 |
验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡 2NO2?N2O4的影响 |
除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com