
【题目】根据所学知识完成题目:
(1)根据氧化还原反应2H2+O2═2H2O,设计成燃料电池,负极通的气体应是 , 正极通的气体应是 .
(2)根据选择电解质溶液的不同,填写下表:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应式 |
|
|
正极反应式 |
|
|
溶液的pH变化 |
|
|
(3)若把H2改为CH4 , KOH作电解质,则负极反应式为 .
【答案】
(1)H2;O2
(2)H2﹣2e﹣=2H+;H2﹣2e﹣+2OH﹣=2H2O;O2+4H++4e﹣=2H2O;O2+2H2O+4e﹣=4OH﹣;增大;减小
(3)CH4+10OH﹣﹣8e﹣=CO ![]() +7H2O
+7H2O
【解析】解:(1)根据电池反应式可知在反应中H2被氧化,O2被还原.H2应该在负极上反应,O2应该在正极上反应,所以答案是:H2;O2;(2)酸性溶液,此时应考虑不可能有OH﹣生成,所以负极发生氧化反应,电极反应为H2﹣2e﹣=2H+ , 正极发生还原反应,电极反应为O2+4H++4e﹣=2H2O,生成水导致氢离子浓度减少,pH增大,所以H2SO4溶液:负极:H2﹣2e﹣=2H+;正极:O2+4H++4e﹣=2H2O;溶液的pH变化:增大;H2应该在负极上反应,O2应该在正极上反应,正极的电极反应为O2+2H2O+4e﹣=4OH﹣;又因为是碱性溶液,不可能有H+参加或生成,故负极的电极反应为H2﹣2e﹣+2OH﹣=2H2O,生成水导致氢氧根离子的浓度减小,所以溶液的pH减小,所以KOH溶液:负极:H2﹣2e﹣+2OH﹣=2H2O;正极:O2+2H2O+4e﹣=4OH﹣;溶液的pH变化:减小,所以答案是:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应式 | H2﹣2e﹣=2H+ | H2﹣2e﹣+2OH﹣=2H2O |
正极反应式 | O2+4H++4e﹣=2H2O | O2+2H2O+4e﹣=4OH﹣ |
溶液的pH变化 | 增大 | 减小 |
;(3)如把H2改为甲烷,KOH溶液做电解质,氧气在正极得到电子生成氢氧根离子,则正极为2O2+4H2O+8e﹣=8OH﹣ , 甲烷失电子在碱溶液中反应,甲烷在负极失电子发生氧化反应在碱溶液中生成碳酸盐,此时不会有CO2放出;负极为CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O,所以答案是:CH4+10OH﹣﹣8e﹣=CO ![]() +7H2O.
+7H2O.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】25℃时,将1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH 或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 该温度下,醋酸的电离平衡常数Ka=![]()
B. a点对应的混合溶液中c(CH3COOH)>c(Na+)>c(OH-)
C. 水的电离程度:c>b>a
D. 当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、Ba2+、Fe3+、Al3+、SO42-、CO32- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列判断正确的是

A. 原溶液中一定含有H+、Fe3+、Al3+,可能含Ba2+
B. 原溶液中含Fe3+和Al3+,物质的量之比为l:l
C. 原溶液中可能含有CO32-
D. 反应最后形成的溶液中含有的溶质只有NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学利用下图来验证某铜银合金完全溶解于浓硝酸对生成的气体除NO2外还含有NO,并测定合金中铜的质量分数。已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体。

(1)写出A中铜与硝酸反应的一个化学方程式________________________。
(2)反应前先打开A部分的活塞K,持续通入一段时间的N2,理由是_______________。若装置中缺少B部分,会影响验证的结果,其原因是____________________。
(3)反应结束后,打开活塞K2,并通入O2,若有NO产生,则D产生的现象是_________。
(4)实验测得的数据如下:合金质量15.0g,13.5mol/LHNO340mL;实验后A溶液:V=40 mL,c(H+)=1.0mol/L,假设反应中硝酸无挥发也没有分解。则反应中消耗的HNO3物质的量为____________mol。
(5)利用A装置中反应后溶液也可确定铜的质量分数,方法是取出A中的反应的溶液,向其中加入足量的_____溶液,然后进行的操作的步骤分别是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-=CuS↓+H2S↑
B. Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+=Fe2++2Fe3++4H2O
C. 碳酸氢铵溶液与过量的苛性钾溶液混和共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:①电解池中X极上的电极反应式为;在X极附近观察到的现象是 .
②Y电极上的电极反应式为;检验该电极反应产物的方法是 .
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则①X电极的材料是 , 电极反应式为 .
②Y电极的材料是 , 电极反应式为 . (说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( ) 
A.蒸馏、蒸发、萃取、过滤
B.蒸馏、过滤、萃取、蒸发
C.萃取、过滤、蒸馏、蒸发
D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把原子数和价电子数相同的分子或离子称为等电子体.人们发现等电子体的结构和性质相似.下列有关无机苯(B3N3H6)有关说法中错误的是( )
A.B3N3H6分子各原子均在同一平面上
B.B3N3H6是由极性键组成的均匀而对称的非极性分子
C.B3N3H6能发生加成反应和取代反应
D.B3N3H6的二氯取代物有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
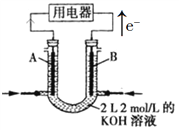
(1)_____(填A或B)处电极入口通甲烷,其电极反应式为_____________。
(2)当消耗甲烷的体积为11.2 L(标准状况下)时,消耗KOH的质量为_______g。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极的电极反应式为____________________。
(4)500 mL KNO3和Cu(NO3)2的混合溶液中c(![]() )=6.0 mol·L1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL。原混合溶液中c(K+)为_________mol·L1。
)=6.0 mol·L1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL。原混合溶液中c(K+)为_________mol·L1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com