
【题目】有关金属的冶炼原理下列说法正确的是( )
A. 肯定发生的是置换反应 B. 肯定发生的是分解反应
C. 肯定发生的是氧化还原反应 D. 只能用金属做还原剂冶炼金属
【答案】C
【解析】
金属的冶炼即是将金属由化合态变为游离态,一定发生了氧化还原反应,但不一定是置换。根据活动性顺序表,金属的冶炼方法可以分为:电解法,热还原法,热分解法,据此分析。
A项,金属的冶炼不一定发生置换反应,例如3CO+Fe2O3![]() 2Fe+3CO2,不属于置换反应,故A项错误;
2Fe+3CO2,不属于置换反应,故A项错误;
B项,金属的冶炼不一定发生分解反应,例如CO+CuO![]() Cu+CO2,不属于分解反应,故B项错误;
Cu+CO2,不属于分解反应,故B项错误;
C项,金属的冶炼是将金属化合物转化成金属单质的过程,金属的化合价发生了变化,所以一定是氧化还原反应,故C项正确;
D项,非金属也可以用作还原剂冶炼金属,例如可以用氢气、一氧化碳、碳作还原剂冶炼金属,故D项错误。
综上所述,本题正确答案为C。


科目:高中化学 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。某工厂以酸性工业废水(含H+、Al3+、Mg2+、Cr2O72—、SO42—)以及硫酸厂废气(SO2)为原料提取铬的工艺流程如下:
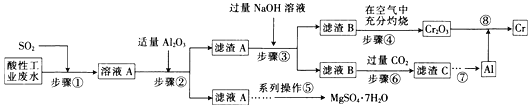
有关数据如下表所示。
化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
完全沉淀的pH | 10.5 | 4.3 | 5.3 |
开始溶解的pH | — | 7.8 | 9.2 |
Ksp近似值 | 5.6×10-12 | 1.3×10-33 | 6.3×10-31 |
请回答下列问题:
(1)步骤①中发生主要反应的离子方程式为__________________________。
(2)步骤②中加入适量Al2O3的目的是__________________________。
(3)为了达到实验目的,步骤③中加入NaOH溶液,应调节溶液的pH范围为_________。
(4)步骤⑥向滤液B中通入过量CO2,反应的离子方程式为__________________________。
(5)工业上也常采用下列装置,利用电解法处理含铬废水。
①在电解过程中阳极区pH增大的原因是_______________________。
②理论上每处理含1 mol K2Cr2O7的废水,阴极区得到的气体体积为_________(标准状况)L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学史的,下列说法中不正确的是
A. 道尔顿——提出原子学说 B. 爱迪生——发现电子
C. 卢瑟福——提出带核的结构模型 D. 玻尔——提出了电子在核外的量子化轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 18 g D2O所含有电子数为10NA
B. 1mol Na2O2发生氧化还原反应时,转移的电子数目一定为2 NA
C. 常温常压下,14g由N2与CO 组成的混合气体含有的原子数目为NA
D. 50 mL 18.4 mol·L-1的浓硫酸与足量铜在加热条件下反应,生成SO2 分子的数目为0.46 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl-、CO32-、OH- 3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是
①滴加Ba(NO3)2溶液; ②过滤; ③滴加Mg(NO3)2溶液; ④滴加AgNO3溶液
A. ①②④②③ B. ④②①②③
C. ①②③②④ D. ④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g)ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g)ΔH2=-23.5kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH3=-41.3kJ/mol.
已知:H-H的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol;
(2)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g)![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2molCH3OCH3、0.4molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2molCH3OCH3、0.4molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.v正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
(3)常温下,将浓度均为2.0mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=8,则混合液中c(CH3COO-)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 硫酸、纯碱(Na2CO3)、氯化钠和生石灰分别属于酸、碱、盐和碱性氧化物
B. 用丁达尔效应可区别FeCl3溶液和Fe(OH)3胶体
C. 生石灰与水混合的过程只发生物理变化
D. H2O、C2H5OH、SO3均含有氧元素,都是氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
A. 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B. 使用生物酶降解生活废水中的有机物,可防止水体的富营养化
C. 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
D. 煤经过气化和液化生成了可燃性气体或液体,变为清洁能源,是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S有剧毒,石油化工中常用以下方法处理石油炼制过程中产生的H2S废气。先将含H2S的废气(其它成分不参与反应)通入FeCl3溶液中,过滤后将溶液加入到以铁和石墨棒为电极的电解槽中电解(如下图所示),电解后的溶液可以循环利用。下列有关说法不正确的是

A. 过滤所得到沉淀的成分为S和FeS
B. 与外接电源a极相连的电极反应为Fe2+-e-=Fe3+
C. 与外接电源b极相连的是铁电极
D. 若有0.20mol的电子转移,得到氢气2.24L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com