
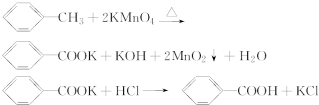
| 序号 | 实验方案 | 实验现象 | 结果 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
分析 一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯,苯甲酸能溶于水,甲苯不溶于水,互不相溶的液体采用分液方法分离,根据实验目的知,从而得到有机相和水相,有机相中含有甲苯、水相中含有苯甲酸,有机相中的甲苯采用蒸馏方法得到无色液体A,A是甲苯,将水相盐酸酸化再蒸发浓缩,根据苯甲酸的溶解度知,得到的固体B是苯甲酸.
(1)分离互不相溶的液体采用分液方法,分离互溶且沸点不同的液体采用蒸馏方法;
(2)甲苯能使酸性高锰酸钾溶液褪色;
(3)结合反应化学方程式中生成的产物和流程中分离步骤分析,白色固体B是苯甲酸与KCl的混合物;依据苯甲酸熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;先检验苯甲酸的检验再检验氯化钾的存在;
(4)苯甲酸和KOH溶液发生酸碱中和反应,根据苯甲酸和KOH之间的关系式计算苯甲酸的质量,从而计算苯甲酸的质量分数.
解答 解:(1)分离互不相溶的液体采用分液方法,根据流程图中,水相和有机相不互溶,可以采用分液方法分离,即操作I为分液,有机相中物质互溶且沸点不同,所以可以采用蒸馏方法分离,即操作II为蒸馏,
故答案为:分液;蒸馏;
(2)通过以上分析知,A是甲苯,甲苯中有甲基,所以能被酸性高锰酸钾氧化为苯甲酸而使酸性高锰酸钾溶液褪色,则可以用酸性高锰酸钾溶液检验甲苯,
故答案为:甲苯;酸性KMnO4溶液;溶液褪色;
(3)①白色固体B加水溶解后,利用苯甲酸和KCl的溶解度随温度变化情况,通过加热浓缩后再冷却结晶,利用过滤可分离出白色晶体和无色滤液,故答案为:冷却结晶,过滤;
②向无色溶液里滴加滴加稀HNO3和AgNO3溶液,有白色沉淀生成,可证明氯离子的存在,故答案为:滴加稀HNO3和AgNO3溶液;
③利用不同温度下的溶解度,分离混合物,得到晶体后通过测定熔点判断是否为苯甲酸,故答案为:取适量加热,测定熔点;白色晶体在122.4℃熔化为液体;
(4)称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol,苯甲酸是一元弱酸和氢氧化钾1:1反应,所以物质的量相同,注意溶液体积变化计算样品中 苯甲酸的物质的量,计算质量分数;样品中苯甲酸质量分数=$\frac{2.4×10{\;}^{-3}mol×4×122g/mol}{1.22g}$×100%=96%,
故答案为:96%.
点评 本题考查了物质性质的实验分析判断,物质分离条件,试剂选择,操作步骤的理解应用,物质成分的实验设计方案、步骤、试剂,样品纯度的计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2是氧化剂 | B. | NaNO2在反应中失电子 | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
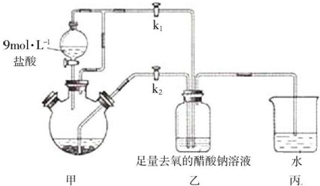
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
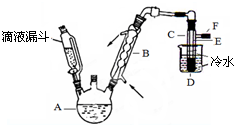 图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.
图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
| 水溶性 | 易溶 | 难溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都加大,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都没有变化,平衡不发生移动 | |
| C. | 正反应速率加大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率加大,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③④ | C. | ②⑥ | D. | ③⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com