
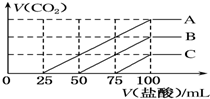
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 原NaOH溶液的浓度为0.2 mol•L-1 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 通入CO2后,不能确定A烧杯中的溶质 | |
| D. | 通入CO2后,C烧杯中溶质成分为NaOH和 Na2CO3,且物质的量相等 |
分析 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,可发生CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,反应后溶液可能有四种情况,①NaOH和Na2CO3,②Na2CO3,③Na2CO3和NaHCO3,④全部为NaHCO3,加入盐酸,首先发生NaOH+HCl=NaCl+H2O、其次发生Na2CO3+HCl=NaHCO3+NaCl,最后发生产生气体NaHCO3+HCl=NaCl+CO2↑+H2O,结合产生气体前后消耗盐酸的体积大小进行判断.
解答 解:浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,可发生CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,反应后溶液可能有四种情况,①NaOH和Na2CO3,②Na2CO3,③Na2CO3和NaHCO3,④全部为NaHCO3,加入盐酸,首先发生NaOH+HCl=NaCl+H2O、其次发生Na2CO3+HCl=NaHCO3+NaCl,最后发生产生气体NaHCO3+HCl=NaCl+CO2↑+H2O,
A.由图可知,加入100mLHCl时,产生二氧化碳的体积最大,说明此时溶液中溶质为NaCl,根据氯离子、钠离子守恒可得n(NaOH)=n(NaCl)=n(HCl)=0.1L×0.2mol/L=0.02mol,故原溶液中氢氧化钠的物质的量浓度=$\frac{0.02mol}{0.1L}$=0.2mol/L,故A正确;
B.曲线B中,从50mL~100mL发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,生成二氧化碳最大时,该阶段消耗盐酸为100mL-50mL=50mL,由方程式可知n(CO2)=n(HCl)=0.05L×0.2mol/L=0.01mol,V(CO2)=0.01mol×22.4L/mol=0.224L=224mL,根据碳原子守恒可知该反应生成的二氧化碳体积等于通入的二氧化碳的体积,即通入的二氧化碳为224mL,故B错误;
C.由图象可知,生成气体前后消耗盐酸的体积比为1:3,说明NaHCO3与HCl反应消耗多,则A中溶质应为Na2CO3和NaHCO3,可确定,故C错误;
D.曲线C中,从75mL~100mL发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,该阶段消耗盐酸为25mL,若NaHCO3完全由反应Na2CO3+HCl=NaHCO3+NaCl转化得到,根据方程式可知,需要消耗盐酸25mL,而产生二氧化碳时消耗盐酸为75mL,大于25mL,说明0mL~75mL阶段盐酸还与氢氧化钠反应,即原NaOH溶液中通入CO2后,所得溶液中的溶质成分NaOH、Na2CO3,由方程式可知n(CO2)=n(HCl)=0.025L×0.2mol/L=0.005mol,根据原子守恒可知n(Na2CO3)=n(CO2)=0.005mol,根据钠离子守恒n(NaOH)=0.02mol-2×0.005mol=0.01mol,故原NaOH溶液中通入CO2后,所得溶液中的n(NaOH):n(Na2CO3)=0.01mol:0.005mol=2:1,故D错误.
故选A.
点评 本题考查混合物的有关计算、化学反应图象等,为高频考点,侧重于学生的分析能力和计算能力的考查,根据图中盐酸的体积判断产生二氧化碳前CO2与NaOH反应过程是解题关键,注意守恒思想与方程式的运用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量 | B. | 密度 | C. | 分子总数 | D. | 质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
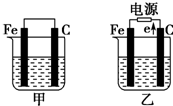 如图所示,甲、乙是电化学实验装置,请回答下列问题:
如图所示,甲、乙是电化学实验装置,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
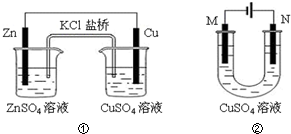
| A. | 装置①中盐桥内的K+移向ZnSO4溶液 | |
| B. | 若装置②中N极为铁棒,M极为石墨,则铁棒不易被腐蚀 | |
| C. | 若装置②用于铁棒镀铜,则M极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中Cu2+浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下测得1 mol N2 的质量为 28 g | |
| B. | 用量筒测得排水法收集制得的氢气体积为 50.28 mL | |
| C. | 用两只250 mL的容量瓶配置0.1 mol/L 500 mL 的 NaOH 溶液 | |
| D. | 用托盘天平称得 2.50 g 胆矾,受热充分失水后,固体质量减轻 0.90 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 相 关 实 验 |  | 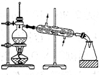 |  |  |
| 目的 | 探究接触面积对反应速率的影响 | 分离沸点相差较大的 互溶液体混合物 | 探究温度对化学 平衡的影响 | 探究不同催化剂对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com