
����Ŀ����ͳ�Ķ�����ѧʵ���ܵ������ֶε���Լ���о���Χ��խ����ȷ�Ȳ��ߡ�DIS���ֻ���Ϣϵͳ���ɴ����������ݲɼ����ͼ������ɣ���Ϊ����ȷ������Һ��pH�ȶ����к͵ζ����о���Ӧ��Խ��Խ�㷺���롣
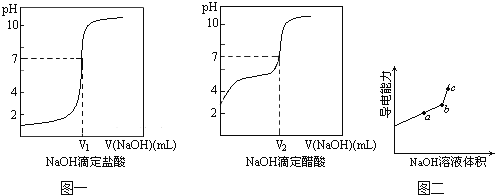
��1��ijѧϰС������DISϵͳ̽��ǿ��Ͳ�ͬ����кͷ�Ӧ��ʵ��������£�
�ٷֱ�����0.1000mol/L��NaOH��HCl��CH3COOH��Һ���á�
����0.1000mol/L��NaOH��Һ�ֱ�ζ�10.00mL0.1000mol/L��HCl��CH3COOH��Һ���������ݲɼ�����pH��������
���ɼ�������Ƶĵζ�������ͼһ��
������ͼ��㲻ͬ��ԭ����_____��������ͼ��V1_____V2 �����������������������
��2����һ��ѧϰС������DISϵͳ�ⶨij������Һ�����ʵ���Ũ�ȣ��Բ�����Һ�����������жϵζ��յ㣬ʵ�鲽�����£�
����_____�����������ƣ���ȡ20.00mL������Һ��Ʒ������ྻ������ƿ�У����Ӻ�DISϵͳ�������ƿ�к���������ˮ���Ƿ��Ӱ��������_____����ǡ�������������ȷ������������ƿ�еμ�0.1000mol/L��NaOH��Һ���������Ļ����ʾ����Һ�������������NaOH��Һ�����ϵ������ͼ����ͼ������
�ڴ�����NaOH��Һ��Ӧ�����ӷ���ʽΪ___________________________��
��ͼ��b��ʱ����Һ�и�����Ũ�ȴ�С�Ĺ�ϵ��_____________________��
����ͼ��ijһ��pH����8����c(Na+)��c(CH3COO��)�ľ�ȷֵΪ_____mol/L��
���𰸡�CH3COOH����ȫ���룬HCl��ȫ���룬��0.1mol/L��CH3COOH��Һ��c(H+����ͬŨ�ȵ�HCl��Һ��c(H+)С��pH�ϴ� �� ��ʽ�ζ��� �� CH3COOH+OH����CH3COO��+H2O c(Na+)��c(CH3COO��)��c(OH��)��c(H+) 9.9��10��7
��������
��������к͵ζ���ԭ�����з�������������ˮ��Ĺ��ɷ�����Һ������Ũ�ȵĴ�С��ϵ��������Һ�еĵ���غ�ȷ�����Һ�еĵ�����ϵ��
��1�����������ᣬ��������ǿ�ᣬ��ˣ�������ͼ��㲻ͬ��ԭ���ǣ�CH3COOH����ȫ���룬HCl��ȫ���룬�� 0.1mol/L��CH3COOH��Һ��c(H+)��ͬŨ�ȵ�HCl��Һ��c(H+)С��pH�ϴ���������ǡ�������кͷ�Ӧ�����ĵı�Һ�����Ӧ��ȣ��������߽Է�Ӧ��pH=7ʱ�����ڴ�����ˮ���ʹ��Һ�ʼ��ԣ�����������Ƚϣ���Ҫ�ټ�һЩ����Һ����ʹpH=7����ˣ�������ͼ��V1��V2 ��
��2��������ʽ�ζ�����ȡ20.00mL������Һ��Ʒ������ྻ������ƿ�У����Ӻ�DISϵͳ�������ƿ�к���������ˮ������Ӱ�쵽��������ʵ������ʲ���Ӱ���������������
�ڴ�����NaOH��Һ��Ӧ�����ӷ���ʽΪCH3COOH+OH����CH3COO��+H2O��
��ͼ��b��ʱ�����������Һǡ����ȫ��Ӧ��������ҺΪ��������Һ�����ڴ��������ֻ�к��ٵ�һ���ַ���ˮ�⣬������Һ�������ԣ�ˮ�ĵ���̶Ⱥ�С������Һ�и�����Ũ�ȴ�С�Ĺ�ϵ��c(Na+)��c(CH3COO��)��c(OH��)��c(H+)��
����ͼ��ijһ��pH����8��c(H+)=110-8mol/L��c(OH��)=110-6mol/L�����ݵ���غ��֪��c(CH3COO��)+ c(OH��)= c(Na+)+c(H+)����c(Na+)��c(CH3COO��)= c(OH��)- c(H+)=110-6mol/L-110-8mol/L=9.9��10��7 mol/L��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��ԭ�ӿ����γ� �� ������ ������ �� ������λ�����ɼ��Ķ�����ʹ���γ��˶��־��ж�����ɵ����ʡ��ش��� �����⣺
(1)��һ�����ܣ���______��(��������������С����)����̬��ԭ�Ӽ۵����Ų�ͼ����![]() ������ Ϊ���Ų���ʽΥ����__________��
������ Ϊ���Ų���ʽΥ����__________��
(2)��(H2NNH2)�����йµ��Ӷ��� �� ������Ŀ֮��Ϊ______���µ���Է�����������ϩ�ӽ������е�Զ������ϩ��ԭ����______��
( 3)����Ľṹ�ɱ� ʾ Ϊ ![]() ��������ˮ���ӿ� �� ��һˮ�϶�����ᾧ ˮ ���� (2HNO3 H2O) �� ˮ�������������������������ӽ�ϣ���д��һˮ�϶�����Ľṹʽ______(��������������ʾ)��
��������ˮ���ӿ� �� ��һˮ�϶�����ᾧ ˮ ���� (2HNO3 H2O) �� ˮ�������������������������ӽ�ϣ���д��һˮ�϶�����Ľṹʽ______(��������������ʾ)��
(4)��������(Na3NO4)Ϊ��ɫ���壬��һ����Ҫ�Ļ���ԭ�ϡ�
��Na3NO4 �����ӵĿռ乹��Ϊ______��������ԭ���ӻ���ʽΪ______��
�ڷֱ�д��һ���� Na3NO4 �������ӻ�Ϊ�ȵ�����������Ӻͷ���______(�ѧʽ)��
���� 573 K �����£�ʵ�������� NaNO3 �� Na2O �������з�Ӧ�Ƶ� Na3NO4��Na2O ������������ͼ�� ʾ��
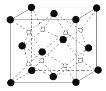
ͼ��������ʾ______(����Na+������O2��)��������������ҵȾ����������______����Na2O �����IJ���Ϊ a pm�����ܶ�Ϊ_____gcm3��(�г�����ʽ���ɣ�NA Ϊ�����ӵ�������ֵ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ӷ���ʽ�У�����ˮ�ⷴӦ����
A.HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
B.CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.PO43-+H3O+ ![]() HPO42-+H2O
HPO42-+H2O
D.H2O+H2O![]() H3O++OH-
H3O++OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������㷺���ڵ��ӹ�ҵ����������������裨SiHCl3�����Ʊ��������Ҫԭ�ϡ��ش��������⣺
(1)��ҵ���Թ�ۺ��Ȼ�������Ϊԭ������SiHCl3ʱ���淢���ķ�Ӧ�У�
Si(s)��4HCl(g)=SiCl4(g)��2H2(g) H��-241kJ/mol
SiHCl3(g)��HCl(g)=SiCl4(g)��H2(g) H��-31kJ/mol
�Թ�ۺ��Ȼ�����������SiHCl3���Ȼ�ѧ����ʽ�� ___��
(2)����γɻ�����LiAlH4���ǽ���������������л��ϳ��еij����Լ�����ˮ�ܵõ���ɫ��Һ�����ҷֽ��ͷų�H2����д����ˮ�ⷴӦ��ѧ����ʽ____��LiAlH4�ڻ�ѧ��Ӧ��ͨ����_______(����������������ԭ��)������ҵ�Ͽ������Ȼ�����⻯��ﮣ�LiAlH4���Ƽ��飬��Ӧ��ü��鼰�����Ρ��÷�Ӧ�Ļ�ѧ����ʽΪ _________
(3)��������绯Ҳ���Ƶü��顣��Ӧ2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)Ϊ�绯�Ƽ�����̵Ĺؼ����裬�˷�Ӧ����һ������PA100�������ڲ�ͬ��Ӧ�¶��²��SiHCl3��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
SiH2Cl2(g)+SiCl4(g)Ϊ�绯�Ƽ�����̵Ĺؼ����裬�˷�Ӧ����һ������PA100�������ڲ�ͬ��Ӧ�¶��²��SiHCl3��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
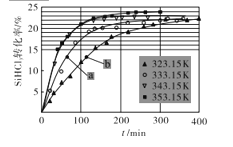
��353.15Kʱ��ƽ��ת����Ϊ____���÷�Ӧ��____��Ӧ������������������������
��323.15Kʱ��Ҫ���̷�Ӧ�ﵽƽ���ʱ�䣬�ɲ�ȡ����Ѵ�ʩ��____��
(4)�Ƚ�a��b����Ӧ���ʵĴ�С��Va ___Vb ������������������������������֪��Ӧ����V��=K1x2SiHCl3��V��=K2xSiH2Cl2xSiCl4��K1��K2�ֱ��������淴Ӧ�����ʳ������뷴Ӧ�¶��йأ�xΪ���ʵ�������������353.15KʱK1/K2 ��____������3λС������
(5)��Ԫ������������Ӧ��ˮ������H2SiO3�������£�0.1mol/L�Ĺ�������Һ��0.1mol/L��̼������Һ�����Ը�ǿ���� ___����ԭ����____����֪��H2SiO3 :Ka1=2.0��10-10��Ka2=2.0��10-12��H2CO3 ��Ka1=4.3��10-7��Ka2=5.6��10-11
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Na2Sx(x��2)�ڽṹ����Na2O2��FeS2��������֮����Na2Sx�ڼ�����Һ����NaClO��Ӧ������Na2SO4������˵���������
A.NaClO��������
B.Na2SO4����������
C.����Ӧ��Na2Sx��NaClO�����ʵ���֮��Ϊ1��13����xΪ5
D.��x=3����Ӧ�����ӷ���ʽΪ��S32-+10ClO-+4OH-=3SO42-+10Cl-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�ÿ��Խ���ʵ�鲢�ܴﵽʵ��Ŀ�ĵ���

ѡ�� | ʵ��Ŀ�� | X���Լ� | Y���Լ� |
A[] | ��MnO2��Ũ������ȡ���ռ����������Cl2 | ����ʳ��ˮ | Ũ���� |
B | ��Cu��ϡ������ȡ���ռ����������NO | ˮ | Ũ���� |
C | ��֤��ʯ�뱥��ʳ��ˮ��Ӧ���ɵ���������ʲ��ռ� | CuSO4��Һ | KMnO4 |
D | CaCO3��ϡ������ȡ���ռ����������CO2 | ����NaHCO3��Һ | Ũ���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ��Cl2����������ƿ�ס��ҡ����������졢���и�ע������Һ���е�һ�֣���������������ͼ��ʾ����ס��ҡ����������졢��ע���Һ��ֱ���( )
��AgNO3��Һ ��NaOH��Һ ��ˮ ������-KI��Һ ��FeCl2��KSCN���Һ ��NaBr��Һ
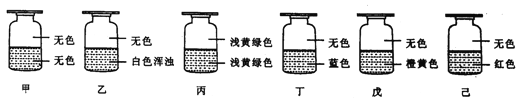
A���ܢ٢ڢޢݢ� B.�ޢ٢ۢܢڢ� C���ޢۢڢܢ٢� D���ڢ٢ۢܢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����屽��ϩ��![]() �����ϩ�Ĺ�������һ�ָ߷�����ȼ�������еͶ������ȶ��Ժõ��ŵ㡣���������գ�
�����ϩ�Ĺ�������һ�ָ߷�����ȼ�������еͶ������ȶ��Ժõ��ŵ㡣���������գ�
(1)д���ù�����Ľṹ��ʽ___________��
(2)ʵ�������ұ���ȡ���屽��ϩ�����Ⱦ�������Ӧ�Ƶ��м���![]() ��д����������Ӧ������Լ�������____________��____________��
��д����������Ӧ������Լ�������____________��____________��
(3)��![]() ������������Һ���ȵõ�A
������������Һ���ȵõ�A![]() ��д��������Ӧ������___________����������Ӧ������±����ˮ�ⷴӦ����Եõ��Ľ���Ϊ__________________��д��A���ɶ��屽��ϩ�ķ�Ӧ�Ļ�ѧ����ʽ_______________��
��д��������Ӧ������___________����������Ӧ������±����ˮ�ⷴӦ����Եõ��Ľ���Ϊ__________________��д��A���ɶ��屽��ϩ�ķ�Ӧ�Ļ�ѧ����ʽ_______________��
(4)��1,3-����ϩΪԭ���Ʊ���������PB��ԭ��֮һ��l,4-��������BDO���ĺϳ�·�ߣ�C4H6![]() C4H6Cl2
C4H6Cl2![]()
![]() BDO��д��������A�Ʊ�BDO�Ļ�ѧ����ʽ��
BDO��д��������A�Ʊ�BDO�Ļ�ѧ����ʽ��
�ٷ�Ӧ��________
�ڷ�Ӧ��________
�۷�Ӧ��________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������벻����ѧ�������Dz�������θҩ�����ű�ǩ�IJ�����Ϣ��
��������Ƭ Ӣ������Ferrous Sulfate Tablets ��Ʒ������������FeSO4��7H2O��ӦΪ��ʾ����95��0%~110��0% | ��������Ƭ Ӣ������Aluminium Hydroxide Tablets |
����Ҫ�ɷ֣����¡�̼��þ���������������� | |
����״����ƷΪ���£���ȥ���º��Ե���ɫ | ����Ӧ֢���ܻ���θ����� |
������ȡ��Ʒ����ȥ���£���ȡ������Լ�൱����������Ƭ0��2g������ϡ����1����ˮ20mL����ҡʹ���������ܽ⣬���ˣ���Һ�����������������εļ���Ӧ | ���÷����������ˣ��ڷ���һ��0��6~0��9g��һ��2~3Ƭ����һ��3�Σ���ǰ1Сʱ���� |
����ϸ�÷������˵���� |
I����������������Ƭ����ǩ�ش����⣺
��1����������Ƭ����ˮ����Һ����ɫ��_______________��
��2���������м���![]() �����ӷ�Ӧ����ʽ��______________________________________��
�����ӷ�Ӧ����ʽ��______________________________________��
��3�������У�����ϡ����1������������__________________________________________��
��4��������������Ƭ�Ƿ������ķ�����________________________________________��
II����������������Ƭ����ǩ�ش����⣺
��1���ܻ���θ�����ijɷ���__________________________________________��
��2��������������Ϊ����θ�������ڷ�ҩ����������������������______________��
A�� ���� B�� ���� C�� ���� D�� ������
��3��д�����������ĵ��뷽��ʽ��_____________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com