
【题目】醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐(已知:25℃,Ka(CH3COOH)=1.69×10-5)。
(1)醋酸钠溶液呈碱性的原因是___(写出有关的离子方程式);
(2)在CH3COONa溶液中离子浓度由大到小的顺序为___(用c(Bn+)表示相应离子浓度);
(3)对于醋酸溶液和醋酸钠溶液的下列说法正确的是___;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离
D.醋酸和醋酸钠混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离
(4)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是___;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(5)常温时,有以下3种溶液,其中pH最小的是___;
A.0.02molL1CH3COOH与0.02molL1NaOH溶液等体积混合液
B.0.01molL1CH3COOH与0.03molL1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(6)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸钠溶液,则pH(CH3COONa)__pH(Na2CO3)。(填:“>”、“<”或“=”)
【答案】CH3COO+H2O![]() CH3COOH+OH c(Na+)>c(CH3COO)>c(OH)>c(H+) BC ABC C <
CH3COOH+OH c(Na+)>c(CH3COO)>c(OH)>c(H+) BC ABC C <
【解析】
(1)醋酸钠为强碱弱酸盐,水溶液在醋酸根离子水解产生氢氧根离子;
(2)CH3COONa为强电解质,完全电离,而醋酸根离子水解导致醋酸根离子浓度小于钠离子浓度;也导致溶液中的c(H+)<c(OH-),醋酸根离子的水解为少量水解;
(3)A.稀释醋酸溶液,醋酸的电离程度增大,稀释醋酸钠溶液则醋酸钠的水解程度也增大;
B.电离与水解均为吸热反应,则升高温度可以促进醋酸电离,也可以促进醋酸钠水解;
C.醋酸和醋酸钠混合液中,存在醋酸的电离平衡和醋酸钠的水解平衡,则醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离;
D.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离;
(4)A.根据质子守恒,醋酸和水都能电离出氢离子;
B.根据溶液呈电中性,溶液中阳离子所带的电荷总数等于溶液中阴离子所带的电荷总数;
C.根据物料守恒,两溶液等体积混合,则c(CH3COO-)+c(CH3COOH)=0.1mol/L;
(5)A.0.02molL1CH3COOH与0.02molL1NaOH溶液等体积混合,溶质为醋酸钠,溶液呈碱性;
B.0.01molL1CH3COOH与0.03molL1NaOH溶液等体积混合,溶质为0.01mol的醋酸钠和0.02mol的NaOH,溶液呈碱性;
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合,溶液为醋酸和醋酸钠的混合液,溶液呈酸性;
(6)根据水解规律,越弱越水解进行判断。
(1)醋酸钠为强碱弱酸盐,水溶液在醋酸根离子水解产生氢氧根离子,导致溶液中c(H+)<c(OH-),离子方程式为CH3COO+H2O![]() CH3COOH+OH;
CH3COOH+OH;
(2)CH3COONa为强电解质,完全电离,而醋酸根离子水解导致醋酸根离子浓度小于钠离子浓度,即c(Na+)>c(CH3COO);也导致溶液中的c(H+)<c(OH-),醋酸根离子的水解为少量水解,c(CH3COO)>c(OH),则溶液中离子浓度由大到小的顺序为c(Na+)>c(CH3COO)>c(OH)>c(H+);
(3)A.稀释醋酸溶液,醋酸的电离程度增大,稀释醋酸钠溶液则醋酸钠的水解程度也增大,与题意不符,A错误;
B.电离与水解均为吸热反应,则升高温度可以促进醋酸电离,也可以促进醋酸钠水解,符合题意,B正确;
C.醋酸和醋酸钠混合液中,存在醋酸的电离平衡和醋酸钠的水解平衡,则醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离,符合题意,C正确;
D.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离,与题意不符,D错误;
答案为BC;
(4)A.根据质子守恒,醋酸和水都能电离出氢离子,则c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),符合题意,A正确;
B.根据溶液呈电中性,溶液中阳离子所带的电荷总数等于溶液中阴离子所带的电荷总数,即c(Na+)+c(H+)=c(CH3COO-)+c(OH-),符合题意,B正确;
C.根据物料守恒,两溶液等体积混合,则c(CH3COO-)+c(CH3COOH)=0.1mol/L,符合题意,C正确;
答案为ABC;
(5)A.0.02molL1CH3COOH与0.02molL1NaOH溶液等体积混合,溶质为醋酸钠,溶液呈碱性;
B.0.01molL1CH3COOH与0.03molL1NaOH溶液等体积混合,溶质为0.01mol的醋酸钠和0.02mol的NaOH,溶液呈碱性;
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合,溶液为醋酸和醋酸钠的混合液,溶液呈酸性;
综上所述,答案为C;
(6)醋酸钠、碳酸钠均为强碱弱酸盐,根据水解规律,越弱越水解,醋酸的酸性大于碳酸氢根离子,则相同浓度时,碳酸钠溶液的pH大。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用_______(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的_____(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_____试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放_____溶液(填化学式),反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1 NaOH溶液分别滴定100 mL 0.1 mol·L-1 HA、HB两种酸溶液。pH随NaOH溶液体积如下图所示,下列判断错误的是
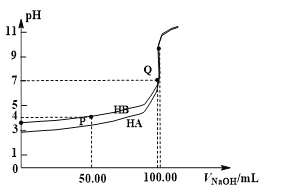
A. 电离常数:Ka(HA) > Ka(HB)
B. Ka(HB)≈10-4
C. pH=7时,c(A—)=c(B—)
D. 中和分数达100%时,HA溶液中存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,请根据实验室和工业上制氢及氢气性质回答相关问题。
I.实验室用稀硫酸与锌粒(黄豆粒大小)制取氢气时加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)少量硫酸铜溶液可以加快氢气生成速率的原因是______________;
(2)要加快上述实验中产生氢气的速率,还可采取的措施有______、_______(列举两种措施)。
(3)当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因____________。
II.工业上海水制氢气的新技术:2H2O![]() 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题:
(1)分解海水的反应属于_____反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极是2H2+2O2-―4e-=2H2O,B极是O2+4e-=2O2-,则A极是电池的____极。
(3)氢气的储存比较困难,最近科学家研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2![]() HCOONa+H2O。下列有关说法正确的是____。
HCOONa+H2O。下列有关说法正确的是____。
A 储氢释氢过程均无能量变化 B 该反应属于可逆反应
C 储氢过程中,NaHCO3被还原 D 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )

A.图中T1<T2
B.M区域内任意点均有c(H+)<c(OH-)
C.两条曲线间任意点均有c(H+)·c(OH-)=Kw
D.XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(G2762011)规定葡萄酒中SO2最大使用量为0.25g·L1,取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.0900mol·L-1NaOH标准溶液进行滴定。
(1)滴定前排气泡时,应选择图中的___(填序号)。
(2)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
a.=10mL b.=40mL c.<10 mL d.>40mL
(3)上述滴定实验中,可选择___为指示剂,选择该指示剂时如何判断反应到达滴定终点:___。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为___g·L1。滴定终点读数时俯视刻度线,则测量结果比实际值___(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co、Ni的化合物在生产生活中有着广泛的应用。
(1)Co元素在周期表中的位置是4周期________族。基态Co原子的简化电子排布式为_________。
(2)乙二胺NH2-CH2-CH2-NH2(缩写符号en)中N原子的杂化方式为________杂化。en可以与Co形成配合物[Co(en)2Cl2]Cl·HCl·2H2O,配离子结构如下左图所示,中心离子的配位数为_______,配合物晶体中可能存在的作用力有___________。
A 离子键 B 极性共价键 C 非极性共价键 D 配位键 E 氢键

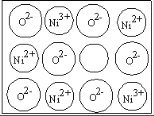
(3)天然氧化镍晶体中总是存在晶体缺陷,如图所示。NiXO晶体中x值为![]() ,若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为______。
,若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为______。
(4)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列, Ni2+填充其中(如图),己知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____g(用a、NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是一种高效、环境友好的发电装置。氢氧燃料电池已用于航天飞机。如图为氢氧燃料电池构造示意图。下列说法中正确的是( )

A.a极为电池的正极,电极反应式为:O2+4e-+2H2O=4OH-
B.b极为电池的负极,电极反应式为:H2-2e-=2H+
C.电解质溶液中K+离子向a极移动
D.当生成1molH2O时,电路中流过电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质间常常相互联系、互相影响中,微粒也不例外。下列各组离子可能大量共存的是![]()
A.常温下水电离出的![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.不能使酚酞试液变红的无色溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
C.能与金属铝反应放出氢气的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.无色透明溶液:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com