
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的是( )

A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
科目:高中化学 来源: 题型:
下列说法正确的是
A.HClO2 →ClO2+Cl2+H2O(未配平), 1 mol HClO2分解时转移电子的物质的量为1 mol
B.标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C.与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示。
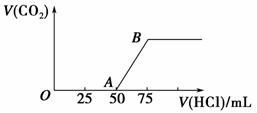
(1)写出OA段所发生反应的离子方程式:________________________________________________________________________。
(2)NaOH在吸收CO2后,所得溶液的溶质为________________________________________________________________________,
其物质的量浓度之比为________。
(3)产生的CO2体积(标准状况下)为________________________________________________________________________。
(4)原NaOH溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)相同体积、相同pH值的盐酸和醋酸
①加入足量的Zn,在丙图中画出H2体积的变化图像

单位时间内,________产生的H2多,反应停止时,______产生的H2多。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是( )
A.溶液的体积10V甲≤V乙
B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH :甲≤乙
查看答案和解析>>
科目:高中化学 来源: 题型:
运用电离常数判断可以发生的反应是( )
| 酸 | 电离常数(25 ℃) |
| 碳酸 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
①HBrO+Na2CO3===NaBrO+NaHCO3
②2HBrO+Na2CO3===2NaBrO+H2O+CO2↑
③HBrO+NaHCO3===NaBrO+H2O+CO2↑
④NaBrO+CO2+H2O===NaHCO3+HBrO
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.电离能最小的电子能量最高
B.在离核最近区域内运动的电子能量最低
C.最易失去的电子能量最高
D.p轨道电子能量一定高于s轨道电子能量
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学想利用图示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
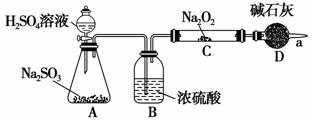
测得反应前C管的质量为m1 g,反应后C管的质量为m2 g,反应后装置D质量增加了n g。请分析:
Ⅰ.装置B的作用_________________________________________________;
装置D的作用_________________________________________________。
Ⅱ.如何检验反应中是否有O2生成______________________________________。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3,假设2:只有Na2SO4
假设3: ______________________________________________。
(1)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:将C中的固体配成溶液,加Ba(NO3)2溶液,得到白色沉淀,加足量稀硝酸,沉淀不溶解。得出结论:产物是Na2SO4。
该方案是否合理________(填“是”或“否”),理由是__________________________________________________________________
________________________________________________________________________。
(2)若假设1成立,某同学以反应前后C管的质量差(m2-m1)g为依据推断生成Na2SO3的质量为(m2-m1)×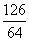 g。老师提示推算不合理,请你分析其中的缘由,________。
g。老师提示推算不合理,请你分析其中的缘由,________。
(3)若假设2成立,则参加反应的Na2O2的物质的量为________mol(列计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com