
ЁОЬтФПЁПвбжЊЃКCЃЈsЃЉ+O2ЃЈgЃЉ=CO2ЃЈgЃЉ ЁїH1 CO2ЃЈgЃЉ+CЃЈsЃЉ=2COЃЈgЃЉ ЁїH2
2COЃЈgЃЉ+O2ЃЈgЃЉ=2CO2ЃЈgЃЉЁїH3 4FeЃЈsЃЉ+3O3ЃЈgЃЉ=2Fe2O3ЃЈsЃЉЁїH4
3COЃЈgЃЉ+Fe2O3ЃЈsЃЉ=3CO2ЃЈgЃЉ+2FeЃЈsЃЉЁїH5
ЯТСаЙигкЩЯЪіЗДгІьЪБфЕФХаЖЯе§ШЗЕФЪЧ
A.ЁїH1ЃО0ЃЌЁїH3ЃМ0B.ЁїH1ЃОЁїH2
C.ЁїH1=ЁїH2+ЁїH3D.ЁїH3=ЁїH4+ЁїH5
ЁОД№АИЁПC
ЁОНтЮіЁП
A. CЃЈsЃЉ+O2ЃЈgЃЉ=CO2ЃЈgЃЉКЭ2COЃЈgЃЉ+O2ЃЈgЃЉ=2CO2ЃЈgЃЉЖМЪЧЗХШШЗДгІЃЌЫљвдЁїH1ЃМ0ЃЌЁїH3ЃМ0ЃЌЙЪAДэЮѓЃЛ
B. CЃЈsЃЉ+O2ЃЈgЃЉ=CO2ЃЈgЃЉЮЊЗХШШЗДгІЃЌЁїH1ЃМ0ЃЌCO2ЃЈgЃЉ+CЃЈsЃЉ=2COЃЈgЃЉЮЊЮќШШЗДгІЃЌЫљвд ЁїH2ЃО0ЃЌЫљвдЁїH2ЃОЁїH1ЃЌЙЪBДэЮѓЃЛ
C. вбжЊЃКЂйCЃЈsЃЉ+O2ЃЈgЃЉ=CO2ЃЈgЃЉ ЁїH1 ЂкCO2ЃЈgЃЉ+CЃЈsЃЉ=2COЃЈgЃЉЁїH2 Ђл2COЃЈgЃЉ+O2ЃЈgЃЉ=2CO2ЃЈgЃЉЁїH3ЃЌИљОнИЧЫЙЖЈТЩПЩжЊЃКЂй=Ђк+ЂлЃЌвђДЫЁїH1=ЁїH2+ЁїH3ЃЌЙЪCе§ШЗЃЛ
D. вбжЊЃКЂл2COЃЈgЃЉ+O2ЃЈgЃЉ=2CO2ЃЈgЃЉЁїH3 Ђм4FeЃЈsЃЉ+3O3ЃЈgЃЉ=2Fe2O3ЃЈsЃЉЁїH4 Ђн3COЃЈgЃЉ+Fe2O3ЃЈsЃЉ=3CO2ЃЈgЃЉ+2FeЃЈsЃЉЁїH5ЃЌИљОнИЧЫЙЖЈТЩПЩжЊЃКЂл=![]() ЁСЃЈ
ЁСЃЈ![]() ЁСЂм+ЂнЃЉЃЌвђДЫЁїH3=
ЁСЂм+ЂнЃЉЃЌвђДЫЁїH3=![]() ЁСЃЈ
ЁСЃЈ![]() ЁСЁїH4+ЁїH5ЃЉЃЌЙЪDДэЮѓЁЃ
ЁСЁїH4+ЁїH5ЃЉЃЌЙЪDДэЮѓЁЃ
ЙЪбЁCЁЃ


 ЪРМЭАйЭЈЦкФЉН№ОэЯЕСаД№АИ
ЪРМЭАйЭЈЦкФЉН№ОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСавКЬхОљДІгк25ЁцЃЌгаЙиа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
A.ФГЮяжЪЕФШмвКpHЃМ7ЃЌдђИУЮяжЪвЛЖЈЪЧЫсЛђЧПЫсШѕМюбЮ
B.pH=4.5ЕФЗЌЧбжжаc(HЃЋ)ЪЧpH=6.5ЕФХЃФЬжаc(HЃЋ)ЕФ100БЖ
C.НЋ1L0.1molЁЄL-1ЕФBa(OH)2ШмвКЯЁЪЭЮЊ2LЃЌpH=12
D.pH=8ЕФNaOHШмвКЯЁЪЭ100БЖЃЌЦфpH=6
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊXЁЂYЪЧжїзхдЊЫиЃЌIЮЊЕчРыФмЃЌЕЅЮЛЪЧKJ/molЃЎИљОнЯТБэЫљСаЪ§ОнХаЖЯДэЮѓЕФЪЧЃЈ ЃЉ
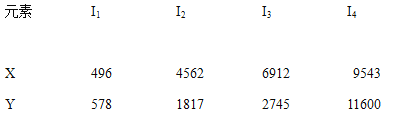
A. дЊЫиXЕФГЃМћЛЏКЯМлЪЧ+1Мл
B. дЊЫиYЪЧЂѓAзхЕФдЊЫи
C. дЊЫиXгыТШаЮГЩЛЏКЯЮяЪБЃЌЛЏбЇЪНПЩФмЪЧXCl
D. ШєдЊЫиYДІгкЕк3жмЦкЃЌЫќПЩгыРфЫЎОчСвЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввЯЉЕФЗжзгЪНЮЊC2H4ЃЌЪЧвЛжжживЊЕФЛЏЙЄдСЯКЭЧхНрФмдДЃЌбаОПввЯЉЕФжЦБИКЭзлКЯРћгУОпгаживЊвтвхЁЃ
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉввЯЉЕФжЦБИЃКЙЄвЕЩЯГЃРћгУЗДгІC2H6ЃЈgЃЉ![]() C2H4ЃЈgЃЉ+H2ЃЈgЃЉ ЁїHжЦБИввЯЉЁЃ
C2H4ЃЈgЃЉ+H2ЃЈgЃЉ ЁїHжЦБИввЯЉЁЃ
вбжЊЃКЂёЃЎC2H4ЃЈgЃЉ+3O2ЃЈgЃЉ=2CO2ЃЈgЃЉ+2H2OЃЈlЃЉ ЁїH1=-1556.8kJЁЄmol-1ЃЛ
ЂђЃЎH2ЃЈgЃЉ+![]() O2ЃЈgЃЉ=H2OЃЈ1ЃЉ ЁїH2=-285.5kJЁЄmol-1ЃЛ
O2ЃЈgЃЉ=H2OЃЈ1ЃЉ ЁїH2=-285.5kJЁЄmol-1ЃЛ
ЂѓЃЎC2H6ЃЈgЃЉ+![]() O2ЃЈgЃЉ=2CO2ЃЈgЃЉ+3H2OЃЈlЃЉ ЁїH3=-1559.9kJЁЄmol-1ЁЃ
O2ЃЈgЃЉ=2CO2ЃЈgЃЉ+3H2OЃЈlЃЉ ЁїH3=-1559.9kJЁЄmol-1ЁЃ
дђЁїH=___kJЁЄmol-1ЁЃ
ЃЈ2ЃЉввЯЉПЩгУгкжЦБИввДМЃКC2H4ЃЈgЃЉ+H2OЃЈgЃЉ![]() C2H5OHЃЈgЃЉЁЃЯђФГКуШнУмБеШнЦїжаГфШыa mol C2H4ЃЈgЃЉКЭ a mol H2OЃЈgЃЉЃЌВтЕУC2H4ЃЈgЃЉЕФЦНКтзЊЛЏТЪгыЮТЖШЕФЙиЯЕШчЭМЫљЪОЃК
C2H5OHЃЈgЃЉЁЃЯђФГКуШнУмБеШнЦїжаГфШыa mol C2H4ЃЈgЃЉКЭ a mol H2OЃЈgЃЉЃЌВтЕУC2H4ЃЈgЃЉЕФЦНКтзЊЛЏТЪгыЮТЖШЕФЙиЯЕШчЭМЫљЪОЃК
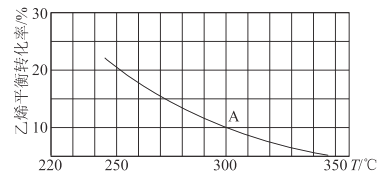
ЂйИУЗДгІЮЊ____ШШЗДгІЃЈЬюЁАЮќЁБЛђЁАЗХЁБЃЉЃЌРэгЩЮЊ____ЁЃ
ЂкAЕуЪБШнЦїжаЦјЬхЕФзмЮяжЪЕФСПЮЊ____ЁЃвбжЊЗжбЙ=змбЙЁСЦјЬхЮяжЪЕФСПЗжЪ§ЃЌгУЦјЬхЗжбЙЬцДњХЈЖШМЦЫуЕФЦНКтГЃЪ§НабЙЧПЦНКтГЃЪ§ЃЈKPЃЉЃЌВтЕУ300ЁцЪБЃЌЗДгІДяЕНЦНКтЪБИУШнЦїФкЕФбЙЧПЮЊb MPaЃЌдђAЕуЖдгІЮТЖШЯТЕФKP=____MPa-1ЃЈгУКЌbЕФЗжЪ§БэЪОЃЉЁЃ
ЂлвбжЊЃКC2H4ЃЈgЃЉ+H2OЃЈgЃЉ![]() C2H5OHЃЈgЃЉЕФЗДгІЫйТЪБэДяЪНЮЊvе§=kе§cЃЈC2H4ЃЉЁЄcЃЈH2OЃЉЃЌvФц=kФцcЃЈC2H5OHЃЉЃЌЦфжаЃЌkе§ЁЂkФцЮЊЫйТЪГЃЪ§ЃЌжЛгыЮТЖШгаЙиЁЃдђдкЮТЖШДг250ЁцЩ§ИпЕН340ЁцЕФЙ§ГЬжаЃЌЯТСаЭЦЖЯКЯРэЕФЪЧ___ЃЈЬюбЁЯюзжФИЃЉЁЃ
C2H5OHЃЈgЃЉЕФЗДгІЫйТЪБэДяЪНЮЊvе§=kе§cЃЈC2H4ЃЉЁЄcЃЈH2OЃЉЃЌvФц=kФцcЃЈC2H5OHЃЉЃЌЦфжаЃЌkе§ЁЂkФцЮЊЫйТЪГЃЪ§ЃЌжЛгыЮТЖШгаЙиЁЃдђдкЮТЖШДг250ЁцЩ§ИпЕН340ЁцЕФЙ§ГЬжаЃЌЯТСаЭЦЖЯКЯРэЕФЪЧ___ЃЈЬюбЁЯюзжФИЃЉЁЃ
AЃЎkе§діДѓЃЌkФцМѕаЁ BЃЎkе§МѕаЁЃЌkФцдіДѓ
CЃЎkе§діДѓЕФБЖЪ§ДѓгкkФц DЃЎkе§діДѓЕФБЖЪ§аЁгкkФц
ЂмШєБЃГжЦфЫћЬѕМўВЛБфЃЌНЋШнЦїИФЮЊКубЙУмБеШнЦїЃЌдђ300ЁцЪБЃЌC2H4ЃЈgЃЉЕФЦНКтзЊЛЏТЪ__10%ЃЈЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБЃЉЁЃ
ЃЈ3ЃЉввЯЉПЩвдБЛбѕЛЏЮЊввШЉЃЈCH3CHOЃЉЃЌЕчНтввШЉЕФЫсадЫЎШмвКПЩвджЦБИГіввДМКЭввЫсЃЌдђЩњГЩввЫсЕФЕчМЋЮЊ_____МЋЃЈЬюЁАвѕЁБЛђЁАбєЁБЃЉЃЌЖдгІЕФЕчМЋЗДгІЪНЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђДњСђЫсФЦ(Na2S2O3)ЪЧживЊЕФЛЏЙЄдСЯЁЃОпгаНЯЧПЕФЛЙдадЃЌПЩгУгкУожЏЮяЦЏАзКѓЕФЭбТШМСЃЌЖЈСПЗжЮіжаЕФЛЙдМСЁЃвзШмгкЫЎЃЌВЛШмгкввДМЁЃNa2S2O35H2Oгк40ЁЋ45ЁцШлЛЏЃЌ48ЁцЗжНтЁЃЪЕбщЪвжаГЃгУбЧСђЫсФЦКЭСђЛЧжЦБИNa2S2O35H2OЁЃжЦБИдРэЮЊЃКNa2SO3+S+5H2OЈTNa2S2O35H2OЁЃФГЛЏбЇаЫШЄаЁзщдкЪЕбщЪвжЦБИСђДњСђЫсФЦОЇЬхВЂЬНОПЦфЛЏбЇаджЪЁЃ
Ђё.ЪЕбщЪвжЦШЁNa2S2O35H2OОЇЬхЕФВНжшШчЯТЃК
ЂйГЦШЁ12.6 g Na2SO3гкЩеБжаЃЌШмгк80.0 mLЫЎЁЃ
ЂкСэШЁ4.0 gСђЗлЃЌгУЩйаэввДМШѓЪЊКѓЃЌМгЕНЩЯЪіШмвКжаЁЃ
ЂлЫЎдЁМгШШ(ШчЭМ1ЫљЪОЃЌВПЗжзАжУТдШЅ)ЃЌЮЂЗаЃЌЗДгІдМ1аЁЪБКѓЙ§ТЫЁЃ
ЂмТЫвКдкОЙ§еєЗЂХЈЫѕЁЂРфШДНсОЇКѓЮіГіNa2S2O35H2OОЇЬхЁЃ
ЂнНјааМѕбЙЙ§ТЫ(ШчЭМ2ЫљЪО)ЁЂввДМЯДЕгВЂИЩдяЁЃЧыЛиД№ЃК
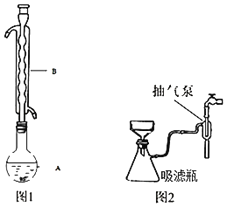
(1)вЧЦїBЕФУћГЦЪЧ_____ЁЃ
(2)ВНжшЂмдкХЈЫѕЙ§ГЬжаВЛФмеєЗЂЙ§ЖШЃЌЦфдвђЪЧ_____ЁЃВНжшЂнШчгћЭЃжЙГщТЫЃЌгІЯШНЋЮќТЫЦПжЇЙмЩЯЕФЯ№ЦЄЙмАЮЯТЃЌдйЙиГщЦјБУЃЌЦфдвђЪЧ_____ЁЃ
(3)ЯДЕгЪБЮЊОЁПЩФмБмУтВњЦЗЫ№ЪЇгІбЁгУЕФЪдМСЪЧ_____ЁЃ
A.ЫЎ B.ввДМ C.ЧтбѕЛЏФЦШмвК D.ЯЁбЮЫс
Ђђ.ЩшМЦвдЯТЪЕбщСїГЬЬНОПNa2S2O3ЕФФГаЉЛЏбЇаджЪ
![]()
(4)ЪЕбщЂйNa2S2O3ШмвКpHЃН8ЕФдвђЪЧ_____(гУРызгЗНГЬЪНБэЪО)ЁЃ
(5)аДГіЪЕбщЂкжаЗЂЩњЕФРызгЗДгІЗНГЬЪН_____ЁЃ
Ђѓ.гУNa2S2O3ЕФШмвКВтЖЈШмвКжаClO2ЕФЮяжЪЕФСПХЈЖШЃЌПЩНјаавдЯТЪЕбщЁЃ
ВНжш1ЃКзМШЗСПШЁClO2ШмвК10.00mLЃЌЯЁЪЭГЩ100mLЪдбљЁЃ
ВНжш2ЃКСПШЁV1 MLЪдбљМгШыЕНзЖаЮЦПжаЃЌЕїНкЪдбљЕФpHЁм2.0ЃЌМгШызуСПЕФKIОЇЬхЃЌвЁдШЃЌдкАЕДІОВжУ30Зжжг(вбжЊЃКClO2+IЉ+H+ЁЊI2+ClЉ+H2O ЮДХфЦН)ЁЃ
ВНжш3ЃКвдЕэЗлШмвКзїжИЪОМСЃЌгУc mol/L Na2S2O3ШмвКЕЮЖЈжСжеЕуЃЌЯћКФNa2S2O3ШмвКV2 mL(вбжЊЃКI2+2S2O32Љ=2IЉ+S4O62Љ)ЁЃ
(6)ЕЮЖЈжеЕуЯжЯѓЪЧ_____ЁЃИљОнЩЯЪіВНжшМЦЫуГідClO2ШмвКЕФЮяжЪЕФСПХЈЖШЮЊ_____ mol/L(гУКЌзжФИЕФДњЪ§ЪНБэЪО)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)ЪЕбщВтЕУ16gМзДМ[CH3OH(l)]дкбѕЦјжаГфЗжШМЩеЩњГЩЖўбѕЛЏЬМЦјЬхКЭвКЬЌЫЎЪБЪЭЗХГі363.25kJЕФШШСПЃЌЪдаДГіМзДМШМЩеШШЕФШШЛЏбЇЗНГЬЪНЃК_______________________ЃЎ
(2)ДгЛЏбЇМќЕФНЧЖШЗжЮіЃЌЛЏбЇЗДгІЕФЙ§ГЬОЭЪЧЗДгІЮяЕФЛЏбЇМќБЛЦЦЛЕКЭЩњГЩЮяЕФЛЏбЇМќЕФаЮГЩЙ§ГЬЃЎвбжЊЗДгІЃКN2(g)+3H2(g)2NH3(g)ЁїH=a kJmolЉ1ЃЎгаЙиМќФмЪ§ОнШчБэЃК
ЛЏбЇМќ | H-H | N-H | NЁдN |
МќФм(kJ/mol) | 436 | 391 | 945 |
ЪдИљОнБэжаЫљСаМќФмЪ§ОнЙРЫуaЕФЪ§жЕ_______________ЃЎ
(3)вРОнИЧЫЙЖЈТЩПЩвдЖдФГаЉФбвдЭЈЙ§ЪЕбщжБНгВтЖЈЕФЛЏбЇЗДгІЕФЗДгІШШНјааЭЦЫуЃЎвбжЊЃК
C(sЃЌЪЏФЋ)+O2(g)ЈTCO2(g) ЁїH1=Љ393.5kJmolЉ1
2H2(g)+O2(g)ЈT2H2O(l) ЁїH2=Љ571.6kJmolЉ1
2C2H2(g)+5O2(g)ЈT4CO2(g)+2H2O(l) ЁїH3=Љ2599kJmolЉ1
ИљОнИЧЫЙЖЈТЩЃЌМЦЫу298KЪБгЩC(sЃЌЪЏФЋ)КЭH2(g)ЩњГЩ1mol C2H2(g)ЗДгІЕФЗДгІШШЮЊЃКЁїH=____________________ЃЎ
(4)дкЮЂЩњЮязїгУЯТЃЌNH4+ОЙ§СНВНЗДгІБЛбѕЛЏГЩNO3ЉЁЃСНВНЗДгІЕФФмСПБфЛЏЪОвтЭМШчЭМЃК
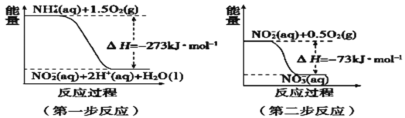
ЕквЛВНЗДгІЪЧ________ЗДгІ(ЬюЁАЗХШШЁБЛђЁАЮќШШЁБ)ЃЌдвђЪЧ_________________________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЦЛЙћЫсЕФНсЙЙМђЪНЮЊHOOC![]() CH2ЁЊCOOHЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
CH2ЁЊCOOHЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ЦЛЙћЫсжаФмЗЂЩњѕЅЛЏЗДгІЕФЙйФмЭХга2жж
B. 1molЦЛЙћЫсПЩгы3mol NaOHЗЂЩњжаКЭЗДгІ
C. 1molЦЛЙћЫсгызуСПН№ЪєNaЗДгІЩњГЩЩњГЩ1mol H2
D. HOOCЁЊCH2ЁЊCH(OH)ЁЊCOOHгыЦЛЙћЫсЛЅЮЊЭЌЗжвьЙЙЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЧњЯпжаЃЌПЩвдУшЪіввЫсЃЈМзЃЌ Ka=1.8ЁС10-5ЃЉКЭвЛТШввЫсЃЈввЃЌ Ka=1.4ЁС10-3ЃЉдкЫЎжаЕФЕчРыЖШгыХЈЖШЙиЯЕЕФЪЧЃЈЃЉ

A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАДвЊЧѓЛиД№ЯТСаЮЪЬтЃК
(1)ХЈЖШЮЊ0.1mol/LДзЫсФЦШмвКжажЪзгЪиКуБэДяЪНЮЊ___________ЃЛ
(2)ЕШХЈЖШЕФNaHCO3ЁЂNa2CO3ЛьКЯШмвКжаЕФЮяСЯЪиКуБэДяЪНЮЊ____________ЃЛ
(3) ХЈЖШЮЊ0.1mol/LNa2CO3ШмвКЕчКЩЪиКуБэДяЪНЮЊ__________ЃЛ
(4) ХнФУ№Л№ЦїУ№Л№ЪБЗЂЩњЗДгІЕФРызгЗНГЬЪЧ______________ЁЃ
(5)ГЃЮТЯТЃЌNaHSO3ШмвКжаСЃзгХЈЖШгЩДѓЕНаЁЕФЫГађ_________ЁЃ
(6)НЋpHЃН8ЕФBa(OH)2ШмвКгыpHЃН5ЕФЯЁбЮЫсЛьКЯЃЌВЂБЃГждк100 ЁцЕФКуЮТЁЃгћЪЙЛьКЯШмвКЕФpHЃН7ЃЌдђBa(OH)2ШмвККЭбЮЫсЕФЬхЛ§БШЮЊ________ЁЃ(вбжЊ100ЁцЃЌKW=1.0ЁС10-12)
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com