
| A. | 硫酸盐都易溶于水 | |
| B. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品-→粉碎-→加水溶解-→过滤-→向滤液中滴加KSCN溶液 | |
| C. | 分别还原a mol Fe2O3所需H2、Al、CO物质的量之比为3:2:3 | |
| D. | 明矾含有结晶水,是混合物 |
分析 A.BaSO4、PbSO4不溶于水;
B.三氧化二铁不溶于水;
C.amolFe2O3被还原得到6amol电子,根据还原剂的化合价变化判断;
D.只含有一种物质的属于纯净物.
解答 解:A.大多数硫酸盐易溶于水,但BaSO4、PbSO4不溶于水,故A错误;
B.Fe2O3不溶于水,且和水不反应,应加入盐酸或稀硫酸溶解后再加KSCN溶液,Fe2O3的检验过程:样品→粉碎→加酸溶解→过滤→向滤液中滴加KSCN溶液,故B错误;
C.amolFe2O3被还原得到6amol电子,则分别消耗H2、Al、CO,3amol、2amol、3amol,物质的量之比为3:2:3,故C正确;
D.明矾化学式为KAl(SO4)2•12H2O,为结晶水化合物,为纯净物,故D错误;
故选C.
点评 本题综合考查元素化合物知识,涉及硫酸盐溶解性、离子的检验、氧化还原反应以及纯净物与混合物的判断,熟悉相关概念是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 取代、加成、取代 | B. | 还原、消去、加成 | C. | 氧化、加成、消去 | D. | 氧化、取代、取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S2O3溶液显弱酸性的原因是:H2S2O3?H++HS2O3- | |
| B. | Na2S2O3溶液显碱性的原因是:S2O32-+2 H2O?H2S2O3+2OH- | |
| C. | Na2S2O3和AgBr反应的离子方程式是:2S2O32-+AgBr?Ag(S2O3)23-+Br- | |
| D. | 定影不能在酸性较强的溶液中进行的原因是:S2O32-+2H+=S↓+SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
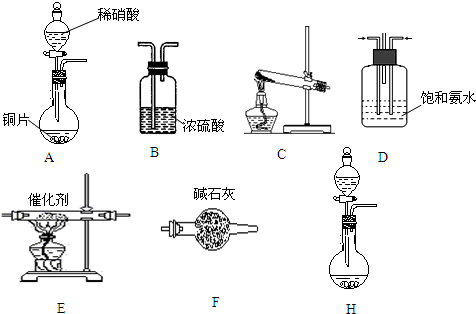
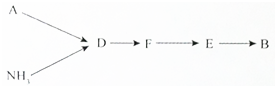
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
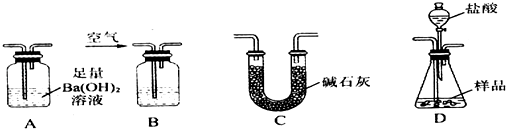
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | HClO有强氧化性,体现漂白作用是其褪色 |
| 然后溶液从无色逐渐变为浅绿色 | 溶液中溶解了大量的氯气,体现浅绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com