
| A. | 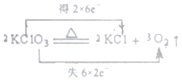 | B. |  | ||
| C. | 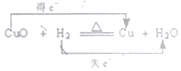 | D. |  |
分析 A.反应中Cl元素化合价由+5价变化为-1价,O元素化合价由-2价升高为0价;
B.Zn失去电子,H得到电子;
C.Cu元素化合价由+2价降低为0价,得到2个电子;
D.Cl元素的化合价由+5降低为0,得到电子,HCl中Cl失去电子.
解答 解:A.反应中Cl元素化合价由+5价变化为-1价,O元素化合价由-2价升高为0价,转移电子数目为12,故A正确;
B.Zn失去电子,H得到电子,转移电子数目为2,故B错误;
C.Cu元素化合价由+2价降低为0价,得到2个电子,氢气失去2个电子,故C错误;
D.Cl元素的化合价由+5降低为0,得到电子,HCl中Cl失去电子,转移电子数目为5,故D错误.
故选A.
点评 本题考查氧化还原反应转移电子数,为高频考点,侧重于学生的分析能力的考查,明确得失电子及数目为解答的关键,注意把握双线桥法标电子转移方法、数目的方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸 | |
| D. | 欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$\stackrel{O_{2}催化剂}{→}$NO$\stackrel{O_{1}和H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 制取Mg:海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{高温}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
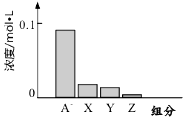 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( )| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 该混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据物质能否导电,可以将化合物分为电解质和非电解质 | |
| B. | 根据氧化物中是否含有金属元素,可以将氧化物分为碱性氧化物和酸性氧化物 | |
| C. | 根据组成元素的种类,将纯净物分为单质和化合物 | |
| D. | 根据分散系的稳定性大小,可以将分散系分为胶体、浊液和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com