
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩 擦剂中氢氧化铝的定性检验。
擦剂中氢氧化铝的定性检验。
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是
___________________________________________________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_________
___________________________________________________________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3
沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:
___________________________________________________________________________。
(4)C中反应生成BaCO3的化学方程式是__________________________________________
___________________________________________________________________________。
(5)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______________________。
科目:高中化学 来源: 题型:
下列实验过程中曲线变化不正确的是
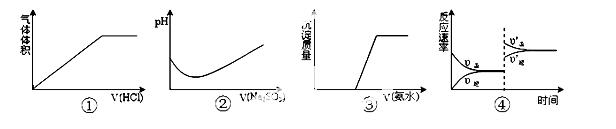
A.①表示Na2CO3溶液中滴入稀盐酸
B.②表示溴水中滴入Na2SO3溶液
C.③表示HCl和MgCl2溶液中滴入氨水
D.④表示一定条件下反应:2SO2+O2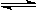 2SO3 ΔH< 0 ,达平衡后,增大压强
2SO3 ΔH< 0 ,达平衡后,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
SO2+2NaOH=== 。
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为 。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO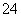 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设。
假设1:只存在SO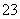 ;假设2:既不存在SO
;假设2:既不存在SO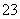 ,也不存在ClO-;假设3: 。
,也不存在ClO-;假设3: 。
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:3 mol·L-1 H2SO4、1 mol·L-1NaOH、0.01 mol·L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。

查看答案和解析>>
科目:高中化学 来源: 题型:
葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可 |
实验流程如下:
C6H12O6溶液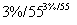


 悬浊液
悬浊液

 Ca(C6H11O7)2
Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是________。
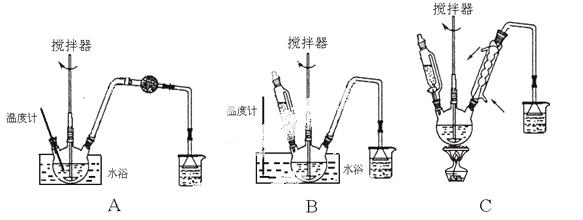
制备葡萄糖酸钙 的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是___________________________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
(5)第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是________。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:
________________________________________________________________________。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容
(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① | |
| ② | |
| …… | 若银镜消失,假设2成立。 |
| 若银镜不消失,假设2不成立。 |
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。
你是否同意丙同学的结论,并简述理由:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积可变的密闭容器中,甲醇在浓硫酸的作用下发生如下反应:
2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-25kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-25kJ·mol-1
A. 2mol甲醇参加反应,放出的热量为25kJ
B. 浓硫酸在反应中只作催化剂
C. 2υ(CH3OH)=υ(CH3OCH3)
D. 升高温度或增大压强均可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应X(g)+3Y(g) 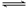 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=3∶1
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数。下列说法正确的是( )
A.标准状况下,11.2L乙烯含有的极性共价键数为NA
B.常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA
C.16.9gBaO2固体中阴、阳离子总数为0.2NA
D.含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是( )
A. 1L 0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个
B. 1L 0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个
C. 2L 0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个
D. 0.1mol/L的H3PO4溶液中,c(H+)∶c(PO43-)<3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com