
| A. | CuCl2、Cu(NO3)2、Ba(OH)2 | B. | Al、Fe、CuSO4 | ||
| C. | MgSO4、Mg(NO3)2、Ba(OH)2 | D. | Al、Cu、FeSO4 |
分析 最后一种物质均为过量,结合溶解后离子之间的反应及金属与盐溶液的置换反应判断滤渣中是否有两种物质,以此来解答.
解答 解:A.Ba(OH)2过量时只生成一种沉淀为Cu(OH)2,其它物质均溶于水,故A不选;
B.CuSO4过量时发生金属与CuSO4溶液的置换反应,滤渣只有Cu,故B不选;
C.Ba(OH)2过量时反应生成两种沉淀为Mg(OH)2、BaSO4,其它物质均溶于水,故C选;
D.FeSO4过量时发生金属与CuSO4溶液的置换反应,滤渣中含Fe、Cu,故D选;
故选CD.
点评 本题考查金属及化合物的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:多选题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的百分含量不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | v正(X)=2v逆(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Bi3Ge3O15 | B. | Bi4Ge3O12 | C. | Bi4Ge3O16 | D. | Bi3Ge3O12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
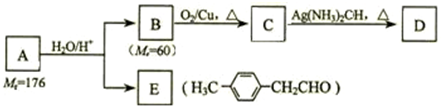
 .
. 、
、 、
、 (其中一种).
(其中一种).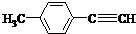 )的一条路线如下:
)的一条路线如下: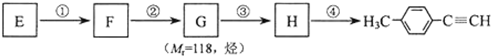
 ;
;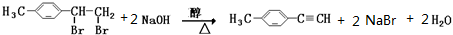 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
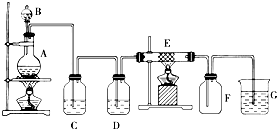
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| B. | 常温下,铁和稀硝酸反应:2Fe+6HNO3═2Fe(NO3)3+3H2↑ | |
| C. | 碳酸氢钠和过量稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 铜和浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
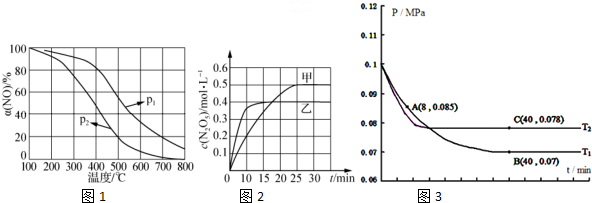
| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 1molO3、2molO2 | ||
| 1molO3、2molNO2 | |||
| 1molO3、2molN2O5 | |||
| 温度/K | T1 | T2 | T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
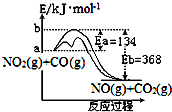 已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.
已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.| 实验序号 | 1 | 2 | 3 | 4 | |
| c(NO2)/mol•L-1 | 1 | 1 | 2 | 2 | |
| c(CO)/mol•L-1 | 1 | 2 | 1 | 2 | |
| v/mol•L-1•s-1 | 750K | p | 2p | 2p | 4p |
| 500K | q | q | 4q | 4q | |
| A. | 不同温度下,增加反应物的浓度不一定可以加快反应速率 | |
| B. | 加入催化剂,改变了反应的途径,加快了反应速率 | |
| C. | 升高反应温度,加快了反应速率,增大了平衡常数 | |
| D. | 750K时,将实验2的容器体积缩小一半,速率v为8p mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com