
| A. | 共价键强弱可决定分子晶体的熔、沸点高低 | |
| B. | O2、CO2、N2都是非极性分子 | |
| C. | C3H8中碳原子都采用的是sp3杂化 | |
| D. | CO的一种等电子体为NO+,它的电子式为 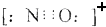 |
分析 A.共价键强弱决定分子的稳定性,与熔沸点无关;
B.O2、CO2、N2均为直线结构,且结构对称;
C.C3H8中碳均形成4个单键;
D.CO的一种等电子体为NO+,结构相似,直线结构,均存在三键.
解答 解:A.共价键强弱决定分子的稳定性,与熔沸点无关,分子间作用力、氢键影响分子的熔沸点,故A错误;
B.O2、CO2、N2均为直线结构,且结构对称,则均为非极性分子,故B正确;
C.C3H8中碳均形成4个单键,则碳原子都采用的是sp3杂化,故C正确;
D.CO的一种等电子体为NO+,结构相似,直线结构,均存在三键,NO+的电子式为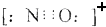 ,故D正确;
,故D正确;
故选A.
点评 本题考查较综合,涉及化学键、杂化、等电子体等,为高频考点,把握原子结构与性质、分子结构与性质为解答的关键,侧重分析与应用能力的考查,注重迁移应用能力的训练,题目难度不大.


科目:高中化学 来源: 题型:推断题
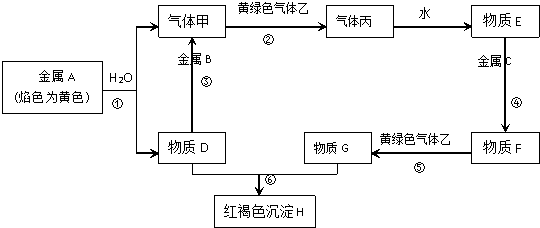
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
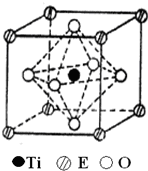 A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
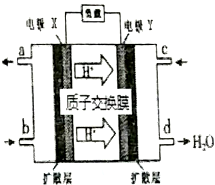
| A. | 氧气应从c处通入,电极Y上发生的反应为:O2+4e-+2H2O═4OH- | |
| B. | 电池在放电过程中,电极X周围溶液的pH增大 | |
| C. | 当该电池向外电路提供2 mol电子时消耗O2约为11.2L | |
| D. | 二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O-12e-+3H2O═2CO2+12H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CN-和N2 | B. | NO和O2 | C. | NO2和CO2 | D. | SO2和ClO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com