
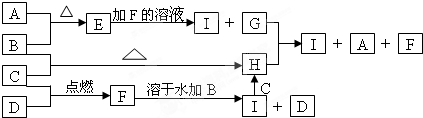


科目:高中化学 来源: 题型:
| 物质 | NH3(g) | O2(g) | NO(g) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | a | b | z | d |
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 I、向AlCl3溶液中滴加NaOH溶液至过量
I、向AlCl3溶液中滴加NaOH溶液至过量查看答案和解析>>
科目:高中化学 来源: 题型:
 溴被称为“海洋元素”.已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.实验室模拟从海水中提取溴的主要步骤为:
溴被称为“海洋元素”.已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.实验室模拟从海水中提取溴的主要步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
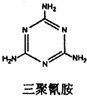 “问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题:
“问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题: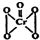 ,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为
,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com