
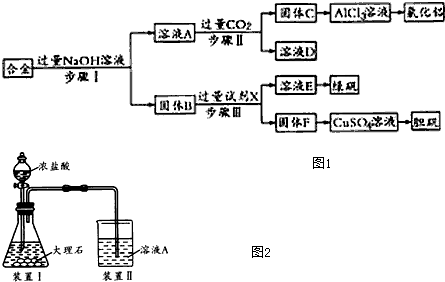
分析 铝、铁和铜的合金中只有金属铝可以和氢氧化钠之间反应生成溶液A偏铝酸钠,固体B是金属铁和金属铜,A中通入过量的二氧化碳可以得到氢氧化铝沉淀C和碳酸氢钠溶液D,金属铁可以和硫酸之间发生反应生成硫酸亚铁和氢气,但是金属铜和稀硫酸之间不反应,硫酸亚铁溶液蒸发浓缩、冷却结晶可以获得绿矾晶体,金属铜可以获得胆矾晶体,
(1)固体和液体的分离用过滤法,过滤用到的仪器:烧杯、玻璃棒、漏斗等;
(2)根据步骤Ⅰ加过量的氢氧化钠发生的反应以及金属铁、铜的性质区别进行解答;
(3)制得的CO2气体中混有氯化氢气体,用饱和的碳酸氢钠除去;
(4)根据固体溶质从溶液中结晶析出的方法是:蒸发溶剂,降温结晶,再过滤分析,硫酸亚铁的溶解度随温度的升高而增大,需采用降温结晶.
解答 解:铝、铁和铜的合金中只有金属铝可以和氢氧化钠之间反应生成溶液A偏铝酸钠,固体B是金属铁和金属铜,A中通入过量的二氧化碳可以得到氢氧化铝沉淀C和碳酸氢钠溶液D,金属铁可以和硫酸之间发生反应生成硫酸亚铁和氢气,但是金属铜和稀硫酸之间不反应,硫酸亚铁溶液蒸发浓缩、冷却结晶可以获得绿矾晶体,金属铜可以获得胆矾晶体,
(1)步骤Ⅰ加过量的氢氧化钠,金属铝和氢氧化钠反应,金属铝溶解其中生成偏铝酸钠溶液,金属铁和金属铜不与氢氧化钠反应,将它们分离用过滤;步骤Ⅰ过滤得到的滤液成分为偏铝酸钠,步骤Ⅱ中向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,溶液中的溶质为碳酸氢钠,将它们分离用过滤;步骤Ⅲ中金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应而金属铜不反应将它们分离用过滤,过滤用到的玻璃仪器:烧杯、玻璃棒、漏斗等.
故答案为:过滤;漏斗;
(2)步骤Ⅰ加过量的氢氧化钠,因铝与碱反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,金属铁和金属铜不与氢氧化钠反应,所以溶液A中的离子主要有AlO2-、Na+、OH-;本实验的目的是用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体,金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应生成硫酸亚铁而金属铜不反应,可以实现三种金属的分离,所以试剂X是稀硫酸,
故答案为:AlO2-、Na+、OH-;稀硫酸;
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的氯化氢气体,氯化氢在水中溶解了部分沉淀氢氧化铝,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去氯化氢的装置,二氧化碳在饱和碳酸氢钠中不溶,氯化氢和碳酸氢钠反应生成二氧化碳气体,所以可在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶,除去二氧化碳中的氯化氢,
故答案为:Al(OH)3+3H+=Al3++3H2O;NaHCO3溶液;
(4)因为硫酸亚铁的溶解度随温度的升高而增大,所以将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶、过滤洗涤,即可得到绿矾,
故答案为:蒸发浓缩;冷却结晶.
点评 本题综合考查物质的制备和性质探究等知识,题目难度中等,试题侧重考查学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
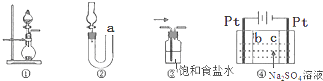
| A. | 图①可用于实验室制取少量NH3或O2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法除去Cl2中混有的HCl | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中b为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可根据同周期元素的第一电离能变化规律,推出Al的第一电离能比Mg大 | |
| B. | 结构和组成相似的分子晶体,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据溶解度小的沉淀易向溶解度更小的沉淀转化的规律,推出在ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有12mol σ键 | |
| B. | Z的最高价含氧酸分子中,羟基氧和非羟基氧个数比为1:1 | |
| C. | Y的气态氢化物分子中H-Y-H键角比Y的最高价氧化物分子中O-Y-O键角小 | |
| D. | Z的气态氢化物比Y的气态氢化物稳定,是因为氢键的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间里生成 n mol A2,同时消耗 2n mol AB | |
| B. | 容器中的总压强不随时间而变化 | |
| C. | A2、B2、AB的物质的量之比满足1:1:2 | |
| D. | 单位时间里生成2n mol AB的同时生成n mol B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑥ | C. | ②③⑤ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com