
| A. | 二氧化硫能使高锰酸钾酸性溶液迅速褪色 | |
| B. | 可以用澄清石灰水鉴别二氧化硫和二氧化碳 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成三氧化硫 | |
| D. | 少量二氧化硫通入浓的氯化钙溶液中能生成白色沉淀 |
分析 A、二氧化硫具有还原性;
B.二者均与石灰水反应生成白色沉淀;
C.反应生成二氧化硫;
D.盐酸的酸性大于亚硫酸的酸性.
解答 解:A、二氧化硫具有还原性,能与使高锰酸钾酸性发生氧化还原反应,高锰酸钾溶液褪色,变为无色,故A正确;
B.二氧化硫和二氧化碳均与石灰水反应生成白色沉淀,现象相同,不能鉴别,故B错误;
C.硫粉在过量的纯氧中燃烧反应生成二氧化硫,不能生成三氧化硫,故C错误;
D.盐酸的酸性大于亚硫酸的酸性,则少量二氧化硫通入浓的氯化钙溶液中,不发生化学反应,故D错误;
故选A.
点评 本题考查二氧化硫的性质,熟悉发生的化学反应是解答本题的关键,侧重二氧化硫及硫的性质的考查,选项D为易错点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl是还原产物 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放(标况下)2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为 ClO-+CH3COOH═HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
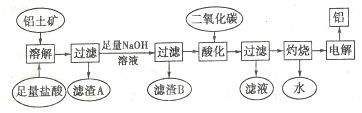
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
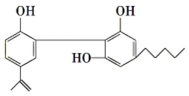 运动员服用兴奋剂的现象在世界大赛中时有发生,某种兴奋剂的结构如图.
运动员服用兴奋剂的现象在世界大赛中时有发生,某种兴奋剂的结构如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改用浓硫酸 | B. | 加热 | ||
| C. | 加入少量CuSO4固体 | D. | 将铁块改成铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
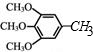 )是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下:
)是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下: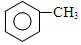 $\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$
$\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$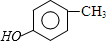 $→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$
$→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$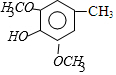 $\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$
$\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$
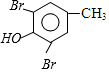 ,C的结构简式为
,C的结构简式为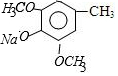 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在0.1 mol?L-1的氨水中滴加0.1 mol?L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol?L-1 | |
| C. | 将c mol?L-1的醋酸溶液与0.02 mol?L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{{2×1{0^{-9}}}}{c-0.02}$ | |
| D. | 将0.2 mol•L-1盐酸与0.1 mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序: c(Cl-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com