
| A. | CH4O和C2H4O2 | B. | C8H10和C4H10 | C. | C2H4和C2H4O | D. | C8H8和C4H8O3 |
分析 无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成水的质量也一定,说明混合物各组分分子中含H量相等,若是由烃组成混合物,则最简式相同,据此分析解答.
解答 解:无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成水的质量也一定,说明混合物各组分分子中含H量相等,
A.CH4O、C2H4O2二者的相对分子量不同,含有H原子数都是4,则二者分子中的含H量不相等,故A错误;
B.C8H10、C4H10最简式不同,说明含氢量不同,不满足题意,故B错误;
C.C2H4、C2H4O中都含有4个H,但是二者的相对分子量不同,则含氢量不同,不满足题意,故C错误;
D.C8H8和C4H8O3的相对分子量相等,都含有8个H原子,则二者的含氢量相同,符号题意,故D正确;
故选D.
点评 本题考查有机物燃烧的有关计算,题目难度中等,注意明确只要总质量一定,完全燃烧时生成水的质量也一定,则说明混合物各组分的分子中含H量相等.


科目:高中化学 来源: 题型:多选题
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 绿色食品是指不含任何化学物质的食品 | |
| C. | 光导纤维是以二氧化硅为主要原料制成的 | |
| D. | 合成纤维的主要原料是石油、天然气、煤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
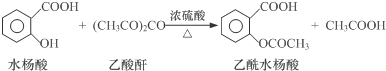
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | |
| 乙酸酐 | 139 | 在水中逐渐分解 | |
| 乙酰水杨酸 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

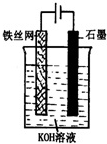
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔点、沸点高低 | |
| B. | 非金属之间发生的置换反应 | |
| C. | 非金属与氢气生成气态氢化物的难易程度 | |
| D. | 非金属元素的最高价氧化物的水化物的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:| A. | TiCl4是还原剂 | B. | Mg被氧化 | ||
| C. | TiCl4发生氧化反应 | D. | Mg得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | O3 | C. | CO2 | D. | 氟氯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| b的范围 | 溶质的种类 | 溶质的物质的量(mol) |
| 0.5 | NaHSO3 | 0.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com