
 ,最简单烯烃的结构简式为
,最简单烯烃的结构简式为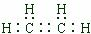 ,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为
,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为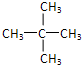 .
. 分析 最简单烷烃是甲烷,最简单烯烃是乙烯,碳原子最外层有4个电子,能形成4个共价键达到稳定结构,每个氢原子能形成一个共价键达到稳定结构,据此写出电子式,最简单芳香烃是苯,据此写出分子式;
C4H10有2种同分异构体,然后根据氢原子的种类确定一氯代物的数目;
戊烷的同分异构体有:CH3-CH2-CH2-CH2-CH3、 、
、 ,烷烃的同分异构体中支链越多沸点越低.
,烷烃的同分异构体中支链越多沸点越低.
解答 解:因碳原子的最外层有4个电子,氢原子最外层1个电子,一个碳原子形成4对共用电子对,一个氢原子形成一对共用电子对,所以甲烷电子式为: ,乙烯的电子式为:
,乙烯的电子式为: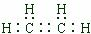 ;
;
最简单芳香烃是苯,分子式为C6H6;
C4H10有2种同分异构体:正丁烷和异丁烷,正丁烷有2种氢原子,异丁烷有2种氢原子,所以一氯代物的数目为4;
戊烷的同分异构体有:CH3-CH2-CH2-CH2-CH3、 、
、 ,烷烃的同分异构体中支链越多沸点越低,所以沸点最低的物质 的结构简式为
,烷烃的同分异构体中支链越多沸点越低,所以沸点最低的物质 的结构简式为 ;
;
故答案为: ;
;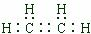 ;C6H6;4;
;C6H6;4; .
.
点评 本题主要考查了电子式、结构式、结构简式的书写、同分异构体的判断等,难度不大,旨在考查学生对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化产物又是还原产物 | |
| B. | 反应通式配平为6NOx+4xNH3=(3+2x)N2+6xH2O | |
| C. | 当x=1时,每生成2.5mol N2,被氧化的气体有3mol | |
| D. | 当x=2时,有1mol气体被还原时,转移的电子为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
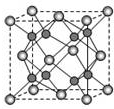
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | NO2和N2O4平衡混合气缩小体积加压后颜色变深 | |
| C. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 | |
| D. | 煅烧硫铁矿利于SO2的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 | |
| B. | 氯气具有强氧化性,因此可用于漂白有色布料 | |
| C. | NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏 | |
| D. | 氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
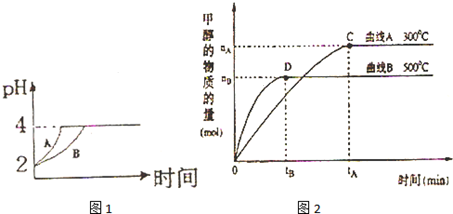
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com