
| A. | 铝合金的大量使用,归功于人们用电解法从氧化铝中获取铝 | |
| B. | 铜的活动性比铁弱,故在海轮外壳装铜块减缓海轮腐蚀 | |
| C. | 用电镀厂的废水中直接灌溉农田,可提高水的利用率 | |
| D. | 甲醛溶液具有杀菌消毒的能力,故能用甲醛溶液浸泡食品 |
科目:高中化学 来源: 题型:选择题
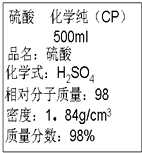
| A. | 该硫酸的物质的量浓度为9.2 mol•L-1 | |
| B. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸25 mL | |
| C. | 该硫酸与等体积的水混合后所得溶液浓度为9.2 mol•L-1 | |
| D. | 该硫酸与等体积水混合后质量分数大于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
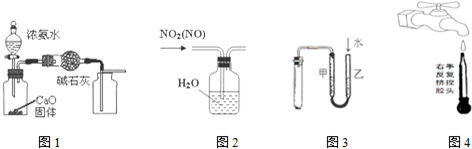
| A. | 用图1装置制取并收集干燥纯净的NH3 | |
| B. | 用图2所示装置可除去NO2中的NO | |
| C. | 用图3所示装置检验装置的气密性 | |
| D. | 图④是实验室洗涤胶头滴管的操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.| 编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5% 5H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
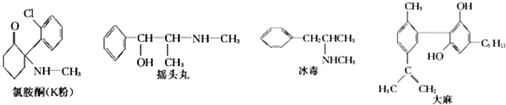
| A. | 冰毒能与盐酸反应 | |
| B. | 摇头丸具有两性 | |
| C. | 1molK粉最多可以与4molH2发生加成反应 | |
| D. | 适当条件下,1mol大麻最多可与3mol Br2发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com