
 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
分析 (1)基态原子的电子排布中4s轨道上只有1个电子的元素为:3d轨道上没有电子但4s轨道上有一个电子的元素、3d轨道上有5个电子且4s轨道上有1个电子的元素、3d轨道上有10个电子且4s轨道上有1个电子的元素;
(2)s区的元素为第IA、IIA族元素;d区的元素为除了第IB、IIB族元素外的过渡元素;
(3)同周期元素从左到右第一电离能逐渐增大;
(4)①根据均摊法计算出晶胞中含有Y原子个数,再确定化学式;
②利用化合物中元素化合价代数和为零求得离子个数比.
解答 解:(1)3d轨道上没有电子但4s轨道上有一个电子的元素为K,3d轨道上有5个电子且4s轨道上有1个电子的元素为Cr,3d轨道上有10个电子且4s轨道上有1个电子的元素为Cu;
故答案为:K、Cr、Cu;
(2)s区的元素为第IA、IIA族元素,所以该周期表中属于s区的元素有:K、Ca,共2种;
d区的元素为除了第IB、IIB族元素外的过渡元素,该周期表中有Sc、Ti、V、Cr、Mn、Fe、Co、Ni,共8种元素;
故答案为:2;8;
(3)同周期元素从左到右第一电离能逐渐增大,则第一电离能:Ga<Ge,
故答案为:<;
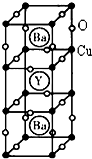
(4)①根据均摊法结合晶胞结构图可知晶胞中含有Y原子个数为1,含有Cu原子个数为:8×$\frac{1}{8}$+8×$\frac{1}{4}$=3,含有Ba原子个数为2,含有O原子个数为:12×$\frac{1}{4}$+8×$\frac{1}{2}$=7,所以化学式为:YCu3Ba2O7,
故答案为:YCu3Ba2O7;
(2)设该物质中+2价的Cu离子个数为x、+3价的Cu离子个数为y,根据化合物中元素化合价代数和为零可知:+3+2x+3y+2×2-2×7=0,且x+y=3,解得:x=2,y=1,所以+2价和+3价的Cu离子个数比为2:1,
故答案为:2:1.
点评 本题考查了晶胞计算、元素周期表和元素周期律的综合应用,题目难度中等,熟练掌握元素周期律内容、元素周期表结构为解答关键,注意明确均摊法晶胞计算中的应用方法.


科目:高中化学 来源: 题型:选择题
 脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )| A. | 该物质有苯环属于芳香烃,1mol该物质能与5molH2加成 | |
| B. | 其分子式为C13H15N2O | |
| C. | 该物质不能与溴水反应 | |
| D. | 该物质能发生水解反应并生成乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如图所示.
某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;仅由极性键形成的非极性分子的结构式为
;仅由极性键形成的非极性分子的结构式为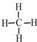 ,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.
,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
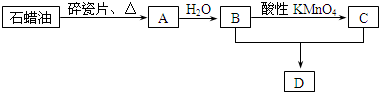
 CH3CH2OH反应类型是加成反应;B+C→D的化学方程式为:CH3COOH+C2H5OH
CH3CH2OH反应类型是加成反应;B+C→D的化学方程式为:CH3COOH+C2H5OH  CH3COOC2H5+H2O.反应类型是酯化反应或取代反应;
CH3COOC2H5+H2O.反应类型是酯化反应或取代反应;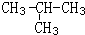 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
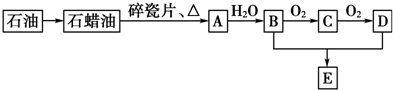
 ,它的一氯取代产物有2种.
,它的一氯取代产物有2种.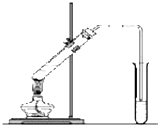
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com