
【题目】为提纯下列物质(括号内物质是杂质),所选用的除杂试剂和分离方法都正确的是
选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | 淀粉(NaCl) | 水 | 渗析 |
B | 乙烷 (乙烯) | 高锰酸钾溶液 | 洗气 |
C | 乙醇(乙酸) | 新制氧化钙 | 过滤 |
D | 苯(溴) | 碘化钾溶液 | 分液 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】人们对原子结构的认识有一个不断深入的过程,下列先后顺序中符合化学史实的是( )
①道尔顿提出的原子论 ②卢瑟福的原子结构行星模型 ③波尔提出的原子力学模型 ④汤姆生提出的葡萄干面包原子模型 ⑤现代量子力学模型
A. ①②④⑤③ B. ①④②③⑤ C. ②①④⑤③ D. ①③⑤②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL 0.1 mol/L的BaCl2溶液与50 mL 0.2 mol/L的NaCl溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子浓度是( )
A.0.2 mol/L
B.0.01 mol/L
C.0.1 mol/L
D.0.02 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列变化:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。(填序号)
化学键没有被破坏的是________;仅发生离子键破坏的是_______ ; 仅发生共价键破坏的是________;既发生离子键又发生共价键破坏的是_______。
(2)已知1mol Si中含1mol Si—Si键。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/ kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
①已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列物质的熔点高低(填“>”或“<”):SiC________Si。
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。
Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生产和生活的说法中,不正确的是
A. 肉制品加入适量的食盐可以防腐
B. “可燃冰”是一种烃类化合物
C. 燃煤中加入生石灰可有效减少污染物的排放
D. 煤的气化、液化和干馏是实现煤的综合利用的主要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
(1)W基态原子的价电子排布式为 。元素X、Y、Z的第一电离能由小到大顺序是 (填元素符号)。
(2)与XYZ-互为等电子体的一种分子为 (填化学式)。
(3)1 mol H2XZ3分子中含有σ键的数目为 。
(4)YH3极易溶于水的主要原因是 。
(5)尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
①尿素分子中C、N原子的杂化方式分别是 。
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 。根据价层电子对互斥理论推测NO3—的空间构型为 。
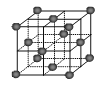
(6)CO2和NH3是制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所得溶液的物质的量浓度等于0.1 mol·L-1的是( )
A.将0.1 mol HCl充分溶解在1 L水中
B.将60 g质量分数为10%的醋酸与940 g水混合
C.将3.1 g氧化钠溶于水并配成1 L溶液
D.将14.2 g Na2SO4·10H2O溶于水中配成1 L溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com